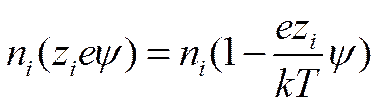 (I I-61)
(I I-61)
Были сделаны попытки использовать иные функции распределения. Однако они не получили широкого признания, так как, не повышая существенно степени точности расчетов, осложняли математическое оформление. Использование уравнения (II-61) вместо.
формулы Больцмана равноценно допущению, что zieψ/kT<1. Это неравенство оправдывается тем лучше, чем ниже концентрация и валентность ионов.
3. Собственными размерами ионов по сравнению с расстояниями между ними и общим объемом раствора можно пренебречь. Таким образом ионы отожествляются с материальными точками и все их свойства сводятся к величине заряда. Это допущение справедливо только для разбавленных растворов. При повышении концентрации ошибка увеличивается и может существенно исказить результаты расчетов.
4. Взаимодействие между ионами исчерпывается кулоновскими силами. Наложение электростатических сил на силы теплового движения приводит к такому распределению ионов в растворе, для которого характерна статистическая шаровая ионная атмосфера. Это допущение также справедливо лишь для разбавленных растворов. При повышении концентрации среднее расстояние между ионами уменьшается и наряду с электростатическими силами появляются другие силы, действующие на более близком расстоянии, в первую очередь силы Ван-дер-Ваальса. Понятие об ионной атмосфере в этом случае также должно быть изменено, так как возникает необходимость учета не только взаимодействия между данным ионом и его окружением, но и между двумя соседними ионами. Размеры ионной атмосферы при увеличении концентрации и зарядов ионов, как это видно из табл. 7, становятся сравнимыми с собственными размерами ионов, что не согласуется с понятием ионной атмосферы.
ТАБЛИЦА 7
Толщина ионной атмосферы для различных типов электролитов как функция их концентрации (растворитель – вода, t=25°C)
|
Тип электролита |
Толщина
ионной атмосферы при концентрации, |
||
|
0,001 моль/л |
0,01 моль/л |
0,1 моль/л |
|
|
1-1 1-2 и 2-1 2-2 1-3 и 3-1 |
96,4 55,8 48,2 39,4 |
30,5 19,3 15,3 13,6 |
9,64 5,58 4,82 3,94 |
5. При создании теории молекулярного строения растворов можно использовать диэлектрическую постоянную, которая является макросвойством системы. При расчетах принималось, что диэлектрические постоянные) раствора и чистого растворителя равны. Эти допущения могут быть справедливыми в случае разбавленных растворов. Для более концентрированных растворов необходимо учитывать изменение диэлектрической постоянной с концентрацией электролита и иметь в виду, что использование усредненной величины диэлектрической постоянной не будет вполне строгим.
Таким образом, все допущения Дебая и Гюккеля, приводят к тому, что их теория может быть применима только к разбавленным растворам электролитов с ионами низкой валентности. Уравнения (II-52 —II-56) и (II-58 —II-60) соответствуют этому предельному случаю и выражают так называемый предельный закон Дебая и Гюккеля, или первое приближение теории Дебая и Гюккеля. Поэтому при проверке теории Дебая и Гюккеля в виде предельного закона необходимо учитывать, что сходимость ее с опытом должна ухудшаться по мере увеличения концентрации электролита, повышения зарядов его ионов и снижения диэлектрической постоянной раствора.
Предельный закон Дебая — Гюккеля дает правильные значения коэффициентов активности 1-1 валентного электролита (хлористого натрия) особенно в очень разбавленных растворах (табл. 8). По мере увеличения концентрации сходимость теории с опытом ухудшается. В случае 2-2 валентного электролита (сульфата цинка) уже при самых малых концентрациях наблюдается расхождение между вычисленными и опытными коэффициентами активности (см. рис. 3 и 4). Так, при концентрации 0,01 моль!л отклонение превышает 30%.
ТАБЛИЦА 8
Сопоставление
опытных и вычисленных коэффициентов активности растворов ![]() и
и ![]() .
(Растворитель – вода, t=25°C)
.
(Растворитель – вода, t=25°C)
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.