![]()
![]() III. • СН3 + Cl : Cl CH3Cl + Cl•
III. • СН3 + Cl : Cl CH3Cl + Cl•
Рост цепи продолжается до тех пор пока не прекратят свое существование свободные радикалы. При отсутствии свободных радикалов в реакционной смеси происходит обрыв цепи – IV. На стадии IV возможны разные варианты соединения радикалов, содержащихся в реакционной смеси.
![]()
![]()
![]() IV. • СН3
+ Cl • CH3Cl; Cl •
+ Cl • Cl2; • СН3 + • СН3 СН3
- СН3
IV. • СН3
+ Cl • CH3Cl; Cl •
+ Cl • Cl2; • СН3 + • СН3 СН3
- СН3
Аналогично идет, например, хлорирование этана:
СН3 - СН3 + Сl2 → Н3С – СН2Сl + НСl
Однако прямое хлорирование алканов с большей длиной углеродной цепи приводит к смеси продуктов, выделение из которой целевого хлорпроизводного является сложной задачей, в частности:
hv
![]() СН3 – СН2 – СН3 + Сl2 CH3 – CH2
– CH2Cl + CH3 – CH – CH3 + HCl
СН3 – СН2 – СН3 + Сl2 CH3 – CH2
– CH2Cl + CH3 – CH – CH3 + HCl
![]() пропан 1-хлорпропан
пропан 1-хлорпропан
Cl
2-хлорпропан
Галогенирование циклоалканов происходит в тех же условиях:
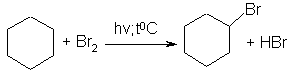
циклогексан бромциклогексан
(циклогексилбромид)
Бензол и его гомологи галогенируются (хлорируются) легче, чем алканы. Так, на холоду и в присутствии катализаторов (AlCl3, FeCl3) галоген замещает атомы водорода в бензольном кольце, а при нагревании или на свету без катализатора замещаются атомы водорода в боковой цепи:
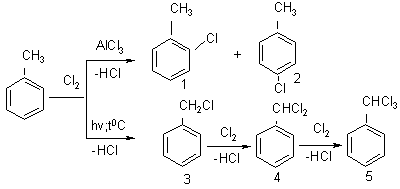
1 – о-хлортолуол, 2 – п-хлортолуол, 3 – бензилхлорид, 4 – бензилиденхлорид, 5 – бензотрихлорид
Реакция идёт в газовой среде (пропускание хлора в парах толуола)
При высокой каталитической активности AlCl3 в процессе хлорирования бензола все атомы водорода могут быть замещены на галоген:
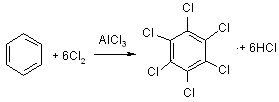
бензол гексахлорбензол
Под действием ультрафиолетового излучения без катализатора к молекуле бензола может присоединяться три молекулы хлора или брома:
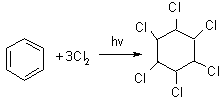
бензол гексахлорциклогексан (гексахлоран) –
промышленный способ получения
При высоких температурах (400-6000С) атомы водорода в алкенах замещаются на атомы галогена, не затрагивая двойной связи:
tºC
![]() СН2 = СН – СН3 + Сl2 CH2 = CH
– CH2Cl + HCl
СН2 = СН – СН3 + Сl2 CH2 = CH
– CH2Cl + HCl
пропилен аллилхлорид
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.