В качестве сырья для производства серной кислоты используют серу, пириты, сернистые газы заводов цветной металлургии, отходящие газы различных производств, содержащие серу, отходы отработанной серной кислоты, а также ангидриды, алунит. Обеспеченность различных районов мира сырьем (серой, пиритами) неравномерна. Наиболее благоприятные условия в отношении ресурсов природной и рекуперированной серы в следующих странах: Россия, Польша, США, Канада, Мексика, Ирак, Саудовская Аравия. Португалия (пириты), Испания (пириты). Остальные страны вынуждены в большей или меньшей мере импортировать серу или пириты, а также использовать отходы других производств, содержащие серу. Например, в Англии 95% выпускаемой кислоты получают из импортной серы. В сернокислотном производстве во всем мире в начале 80-х годов использовались следующие виды сырья, %: сера – 60; пириты – 19,отходящие газы цветной металлургии – 18, прочие – 3. В отдельных развитых странах соотношение использованных сырьевых источников заметно отличается. Так, в США, Японии и ФРГ доли разных видов сырья составляют соответственно, %: сера – 82, 24 и 41; пириты – 2, 14, 28; отходящие газы цветной металлургии – 9, 58 и 25; прочие – 7, 4 и 6. В СССР в 1983 г. выработка серной кислоты основывалась на использовании в качестве сырья, %: сера – 56,3; пириты – 26,8; отходящие газы цветной металлургии –13,1; прочие – 2,8. Среди последних методом мокрого катализа из сероводородного сырья получено 2,3% серной кислоты.
Элементарная сера как важнейший источник сырья
Масса серы в земной коре составляет 0,05%. По распространенности среди элементов сера занимает 15-е место. В месторождениях она встречается как в свободном виде (природная сера в серных рудах) так и в химически связанном (серный колчедан, сульфидные руды цветных металлов, сульфаты в виде залежей гипса, ангидрида, глауберовой соли. Химические соединения серы присутствуют в качестве примесей нефти, природном газе, углях, сланцах. Наибольшая доля серы содержится в сульфидных рудах (46,5%); на втором месте сульфатные залежи (37,7%); третье место занимают топливно-энергетические ресурсы в виде нефти, газа и угля (12,5%); на последнем месте – природная сера (15,3%).
При классификации способов получения элементарной серы прежде всего различают производства природной и регенерированной серы. В настоящее время в связи с истощением богатых природной серой залежей серных руд в переработку более широко вовлекают менее богатое серой сырье и серосодержащие отходы.
Совершенствование методов производства регенерированной серы не только в промышленно развитых странах, где месторождения серосодержащего сырья бедны (Япония, Франция), но и в обеспеченных сырьем странах стимулируется повысившимися экологическими требованиями к очистке промышленных газов и ростом спроса на серу. В настоящее время наблюдается тенденция к уменьшению доли природной серы в общем ее выпуске и значительному увеличению производства регенерированной серы (рис.7.3).
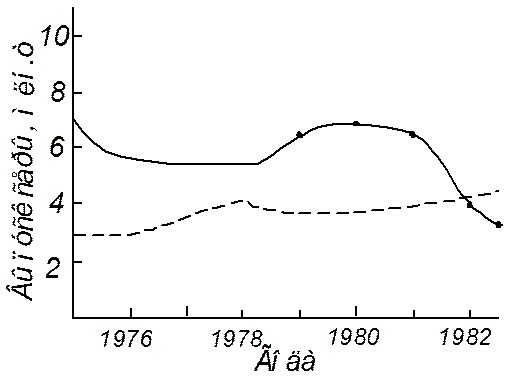
Рис. 7.3. Динамика выпуска природной (1) и регенерированной (2) серы в США за период 1975 – 1983 г.
Доля самородной серы в сырьевом балансе России также постоянно уменьшается: 1987 г. – 51%, 1990 г. – 34%, 1995 г. – 16,8%, 2000 г. – 13,3%. В России введена в строй 1 – я очередь Астраханского газоконденсатного комплекса мощностью 1,2 млн.т серы в год. Всего введено 3 очереди.
Свойства серной кислоты
Серную кислоту следует рассматривать как соединение, состоящее из одной молекулы серного ангидрида SO3 с одной молекулой воды. Следовательно, безводная серная кислота содержит 81,63% SO3 и 18,7% H2О.
В технике под серной кислотой подразумеваются любые смеси серного ангидрида с водой.
Если 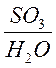 < 1, т.е. на 1 моль SO3
приходится более 1 моля H2О, то такая смесь
называется водным раствором H2SO4.
< 1, т.е. на 1 моль SO3
приходится более 1 моля H2О, то такая смесь
называется водным раствором H2SO4.
Если 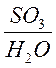 = 1, т.е. на 1 моль SO3
приходится 1 моль H2О, то эта смесь будет
безводная серная кислота или моногидрат.
= 1, т.е. на 1 моль SO3
приходится 1 моль H2О, то эта смесь будет
безводная серная кислота или моногидрат.
Если 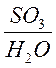 > 1, т.е. на 1 моль SO3
приходится менее 1 моля H2О, то такая смесь
называется олеумом.
> 1, т.е. на 1 моль SO3
приходится менее 1 моля H2О, то такая смесь
называется олеумом.
Стандарты на серную кислоту и олеум
Отечественная промышленность выпускает несколько сортов продукции, различающихся содержанием H2SO4 или SO3, а также содержанием примесей (табл.7.2):
1. Кислота серная аккумуляторная. ТУ 667-73.
2. Кислота серная контактная (улучшенная, техническая).ТУ 2184-77.
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.