Таким образом, энергетическое состояние изолированного атома представляет собой дискретный набор разрешенных значений, из которых лишь все уровни, соответствующие s - состояниям, являются невырожденными. В невозбужденном состоянии все наинизшие уровни заняты, как, например, у атома натрия (рис. 1.4.3).
Вообще уровень со значением орбитального квантового числа l характеризуется g = (2 l + 1) - кратным вырождением, для его заполнения требуется 2g == 2(2l +1)-электронов. В физической литературе иногда описывают s -состояния как двукратно вырожденные, подчеркивая тем возможность существования лишь двух значений электронных спинов. Понятие "вырождение" применяется как к уровням, занятым электронами, так и к свободным разрешенным уровням.
При возбуждении атомов сторонними воздействиями он может переходить в более высокие, но только разрешенные состояния, что соответствует переходу электронов верхних уровней (3s, 2p) на более высокие разрешенные уровни (3s, 3р).
Энергетическое состояние атома решающим образом зависит от наличия и величины внешнего силового поля. В сильном внешнем поле, например, электрическом или магнитном, вырождение уровней снимается за счет расщепления каждого из них на (2l + 1) близко расположенных подуровней.
Однако влияние внешнего поля различно для различных атомных уровней. Уровни электронов внутренних оболочек, сильно взаимодействующих с ядром, испытывают лишь очень слабое расщепление, которым можно пренебречь. Внешние, и особенно валентные, электроны, более удаленные от ядра и экранированные от него внутренними оболочками, под действием внешнего поля претерпевают сильные изменения энергетического состояния.
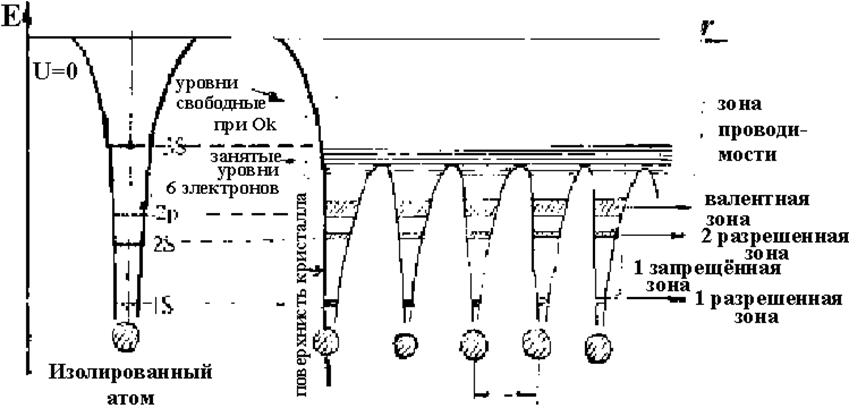
Внутренние электрические поля в атомах достигают напряженности порядка 108...109 В/м и потому при сближении атомов в процессе формирования конденсированной структуры их взаимное влияние существенным образом определяет результирующее энергетическое распределение электронов и ионов, составляющих кристалл или аморфное тело. Сближение группы из N атомов с g-кратным вырождением занятого или свободного уровня сопровождается N-кратным расщеплением каждого из этих уровней. При этом расщепление уровней внутренних электронных оболочек пренебрежимо мало в отличие от расщепления уровней, соответствующих валентным электронам. Узкие дискретные энергетические уровни изолированных атомов "размываются" в энергетические зоны разрешенных значений энергии. Ширина разрешенных энергетических зон увеличивается по мере удаления электронов от ядер. Между зонами разрешенных значений энергии располагаются зоны значений, запрещенных для электронов в данной кристаллической решетке или аморфной структуре.
На рис.1.4.4 приведена упрощенная схема возникновения разрешенных и запрещенных энергетических зон при объединении в кристаллическую решетку в виде одномерной цепочки группы из пяти атомов натрия, а на рис.1.4.5 - общая схема возникновения энергетических зон.
 |
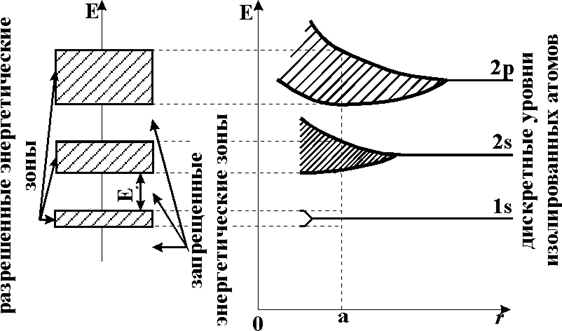 |
Для переходов от атома к атому валентных электронов потенциальный барьер отсутствует и потому они образуется облако неразличимых частиц, распределенных по весьма близко расположенным энергетическим подуровням. В 1 см3 твердого тела содержится около N = 1023 атомов. Если энергетический уровень имел в атоме (2l + 1)-кратное вырождение, то соответствующая ему зона будет состоять из N(2l + 1) подуровней, способных вместить 2 N(2l+1) электронов.
При ширине разрешенной зоны порядка 1...5 эВ промежуток между подуровнями в зоне равен »10-22 эВ, то есть настолько ничтожен, что можно считать распределение по энергиям внутри зоны практически непрерывным. Важно учитывать, что в любой зоне число подуровней конечно, и это играет определяющую роль в характере распределения электронов по энергиям.
Так, невозможно дополнительное внедрение электронов в полностью занятую зону. Внутренние зоны, соответствующие внутренним электронным оболочкам, постоянно заняты. Однако, если вследствие некоторого воздействия, например, рентгеновского кванта, электрон с внутренней оболочки будет выбит, его место займет электрон из более удаленной зоны, освободив место для еще более высокоэнергетичных электронов. Такие места, вакантные для занятия электроном, принято называть "дырками", они представляют собой обычно незанятые межатомные связи.
Многообразие электронных конфигураций изолированных атомов и типов межатомных связей порождает множество вариантов зонного строения конденсированных веществ. Некоторые типы зонного строения представлены на рис.1.4.6.
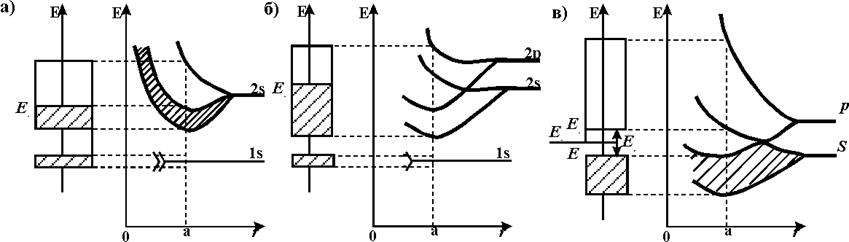 |
Рис.1.4.6. Формирование энергетических зон электронов при образовании кристаллической решетки: а - возникновение частично заполненной зоны проводимости у лития; б - возникновение гибридной частично заполненной зоны при перекрытии зон, образованных при расщеплении занятого уровня 2s и свободного уровня 2р у бериллия; в – образования зон при формировании алмазной структуры, являющейся диэлектриком; ЕV - энергия вершины валентной зоны, ЕC - энергия дна зоны проводимости, ЕF - энергия уровня Ферми
Электроны в зонах стремятся занять наинизший свободный уровень. Наивысший энергетический уровень, занятый электроном при температуре 0 Кельвина, называется уровнем Ферми. В металлах и проводниках этот уровень располагается в зоне проводимости.
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.