mi = m0i + RT lnP ( 7 )
pi – парциальное давление компонента i в смеси; m0i – значение mi при pi = 1 бар. Химический потенциал характеризует способность данного компонента к выходу из данной фазы. Переход компонента может происходить самопроизвольно только из фазы, для которой его химический потенциал больше, в фазу, для которой он меньше, он выравнивается и достигается равновесие.
Химическое равновесие.
n1А1 + n2А2 = n3А3 + n4А4
При T = const и Р = const dG = Smidni для конкретной реакции количество вещества ni равно стехиометрическим коэффициента , находящимся в уравнении реакции.
DG = Snimi подставим значение химического потенциала из уравнения (7) в данное выражение и сделаем соответствующие преобразования:
DG= S in (mi0 +RT ln pi) = S (ni mi0 + RT n i ln pi) = ni mi0 + S RTni ln pi =
= Snimi0 + RT S ln ![]() = + RT D ln (
= + RT D ln ( ![]() )
)
В случае химического равновесия DG = 0 и предыдущее равенство принимает вид:
D (nimi0) = - RT D ln ( ![]() ) раскроем значение скобок
- это разница между логарифмами давлений продуктов и реагентов
реакции. Получаем следующее выражение:
) раскроем значение скобок
- это разница между логарифмами давлений продуктов и реагентов
реакции. Получаем следующее выражение:
D (nimi0) = - RT ( ![]() ) = -RT ln
) = -RT ln 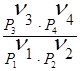
При постоянных
температуре и давлении D (nimi0) = const, значит 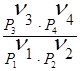 =
const = KP - константа равновесия
=
const = KP - константа равновесия
D (nimi0) = -RT ln KP из этого следует что:
DG = -RT ln KP + RT ln 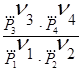 (8)
данное уравнение называется уравнение изотермы химической реакции и применяется
для расчетов изменения энергии Гиббса в газообразной среде. Для растворов
используют энергию Гельмгольца. При постоянных объеме и температуре энергия
Гельмгольца имеет следующее значение:
(8)
данное уравнение называется уравнение изотермы химической реакции и применяется
для расчетов изменения энергии Гиббса в газообразной среде. Для растворов
используют энергию Гельмгольца. При постоянных объеме и температуре энергия
Гельмгольца имеет следующее значение:
DA = -RT ln KC + RT ln 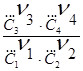 ; С1 , С2 , С3 ,
С4 - концентрации
; С1 , С2 , С3 ,
С4 - концентрации
Если исходные парциальные давления веществ в уравнении (8) равны по 1, то уравнение (8) примет вид:
DG0 = - RTln KP (9) уравнение нормального сродства
Зависимость константы равновесия от температуры.
Термодинамическая константа не зависит от парциальных давлений газов, а зависит от температуры. Приведем объединенное уравнение Гиббса-Гельмгольца.
![]()
Произведем в этом уравнении некоторые замены:
DG = Ty ; ![]()
![]()
Вместо y подставим значение энергии Гиббса из уравнения нормального сродства:
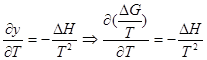 ;
; ![]() Вынесем –
R за значение дифференциала и поделим левую и правую части
уравнения на – R
Вынесем –
R за значение дифференциала и поделим левую и правую части
уравнения на – R
![]() Уравнение
изобары химической реакции.
Уравнение
изобары химической реакции.
Аналогичное уравнение можно получить при постоянных объеме и температуре, но в этом случае используется энергия Гельмгольца, и константа включает в себя концентрации.
![]() Уравнение
изохоры химической реакции.
Уравнение
изохоры химической реакции.
ЧАСТЬ 2. ОСНОВЫ КОЛЛОИДНОЙ ХИМИИ.
Коллоидные системы это такие системы, в которые входят частицы крупнее, чем молекула, но мельче чем макротело. Коллоидная химия оперирует понятиями, сплошная фаза и дисперсная фаза.
Сплошная фаза- это фаза, которая не прерывается на всем своем протяжении.
Дисперсная фаза- это фаза, которая ограничена в пространстве сплошной фазой.
Коллоидная система обязательно является сильно раздробленной (мелко дисперсной). Дисперсность – величина обратная размеру частиц:
D = 1/r , измеряется в м-1 или см-1.
Классификация коллоидных систем по Оствальду.
Эта классификация основана на агрегатном состоянии фаз.
|
Обозначение |
Название |
Примеры |
|
Т/Ж |
Золи |
Речная и сточная вода |
|
Ж/Ж |
Эмульсии |
Молоко, крема, битум |
|
Г/Ж |
Газовые эмульсии |
Лимонад, коктейль |
|
Ж/Т |
Гели |
Кисель, холодец |
|
Г/Т |
Ксерогели |
Канифоль, мел, пемза |
|
Т/Т |
Тверд. колл. Растворы |
Сталь, малахит, яшма |
|
Т/Г |
Дым, пыль |
|
|
Ж/Г |
Аэрозоли |
Туман, тучи |
|
Г/Г |
Атмосфера Земли |
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.