1.При постоянном объеме ( V = const), изохорный процесс
dQ = d U = CV dT
Проинтегрируем полученное уравнение:
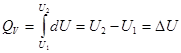
DU -тепловой эффект реакции при постоянном объеме
5. При постоянном давлении (Р= const), изобарный процесс
dQ = d U + Р d V = d U + d (P V) = d (U + PV) = d H
U + PV = H ; Н - энтальпия реакции
d H - тепловой эффект реакции при постоянном давлении, он обладает свойствами функции.
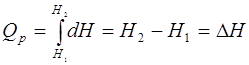 QP = d H
QP = d H
Связь тепловых эффектов реакции
n1А1 + n2А2 = n3А3 + n4А4
n1 , n2 , n3 , n4 - стехиометрические коэффициенты начальных и конечных веществ.
Н1 Н2 Н3 Н4
![]()
![]() n1(U1
+ PV) n2 (U2
+ PV) n3(U3 + PV) n4(U4 + PV)
n1(U1
+ PV) n2 (U2
+ PV) n3(U3 + PV) n4(U4 + PV)
энтальпия начальных энтальпия конечных состояний состояний
DН = (n3 (U3 + PV) + (4n U4 + PV)) - (n1 (U1 + PV) + (2 n U2 + PV)) =
= (n3 U3 + n4 U4 - n1 U1 - n2 U2) + (n1 + n2 - n3 - n4) PV = D U + Dn PV = DU + Dn R T
DН = D U + D n R T
Термохимия. Закон Г. И. Гёсса.
Термохимия - раздел физической химии, изучающей тепловой эффект реакций. Если система приобретает тепло - эндотермическая реакция (DН >0), если система отдает тепло - экзотермическая реакция (DН<0).
В основе термохимии лежит закон Гесса:
Тепловой эффект реакции не зависит от пути протекания процесса, а однозначно определяется начальным и конечным состоянием системы.
DН
![]()
![]()
 S SO3
S SO3
DН1 DН2
SO2
DН = DН1 + DН2 ; DН - DН1 + DН2 = 0 ; Sцикл DН = 0
Первое следствие из закона Гесса. Определение теплового эффекта исходя из теплот образования веществ.
Теплотой
образования вещества называется тепловой эффект реакции образования этого
вещества из простых веществ взятых в устойчивом состоянии при стандартных
условиях ( Т = 0 К; Р = 1 атм. ). ![]()
для простых веществ равна 0. Например, для образования кристаллогидрата сульфата натрия (Na2SO4 × 10 H2O) требуются простые вещества, поэтому теплотой образования кристаллогидрата сульфата натрия будет называться такое количество теплоты, которое выделяется при получении этого сложного вещества из простых.
2Naтв. + Sтв. + 7О2 тв. + 10 Н2 тв. = Na2SO4 × 10 H2O - DН
Тепловой эффект реакции равен разности теплот образования конечных и начальных веществ.
DН = S(ni Нi)КОН. В-В - S(ni Нi)НАЧ. В-В
Второе следствие из закона Гесса. Определение теплового эффекта исходя из теплот сгорания веществ.
Теплотой сгорания вещества называется
тепловой эффект реакции сгорания этого вещества с образованием простых веществ,
полученных в устойчивом состоянии при стандартных условиях ( Т = 0 К; Р = 1
атм.). Простыми веществами называют образующиеся при сгорании оксиды. ![]() для
простых веществ равна 0
для
простых веществ равна 0
Например, при сгорании этилового спирта (С2Н5ОН) образуются простые вещества (оксиды), не способные к дальнейшему сгоранию, поэтому тепловой эффект реакции будет состоять из теплоты выделяющейся при сгорании спирта.
С2Н5ОН + О2 = СО2 + Н2О - DН
Тепловой эффект реакции равен разности теплот сгорания начальных и конечных веществ.
DН = S(ni Нi)НАЧ. В-В - S(ni Нi)КОН. В-В
Зависимость теплового эффекта от температуры.
Тепловой эффект реакции может увеличиваться с ростом температуры, уменьшаться с уменьшением температуры и не зависеть от температуры.
n1А1 + n2А2 = n3А3 + n4А4
n1Н1 n2Н2 n3Н3 n4Н4
DН = (Sni Нi кон. в-в - Sni Нi)нач. в-в = (n3Н3 + n4Н4) - (n1Н1 + n2Н2)
Нужно взять частную производную по температуре, зависимую от давления.
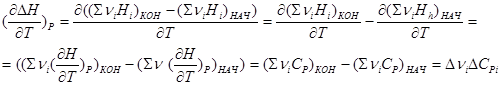
СР – изобарная теплоемкость
Закон Кирхгофа, который формулируется так:
Температурный коэффициент теплового эффекта процесса равен изменению теплоемкости системы, происходящему в результате процесса.
Второй закон термодинамики.
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.