|
|
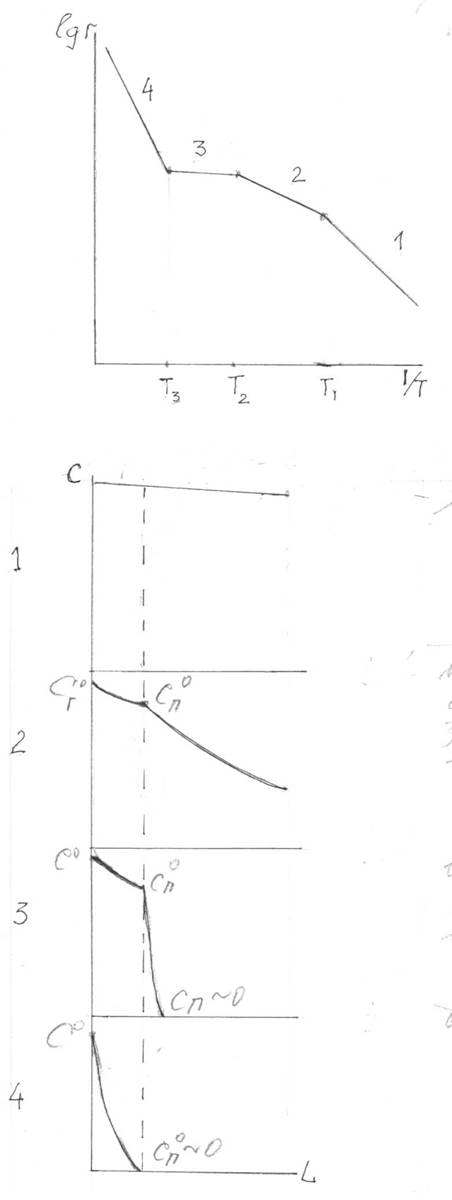
Рис. 6.6Области протекания гетерогенного каталитического процесса: 1-кинетическая, 3, 2- внешне- и внутридиффузионная, 4-гомогенная некаталитическая
E4 > E1 > E2 >> E3 ~5-10 kJ/mole
E1 ~ 2 E2
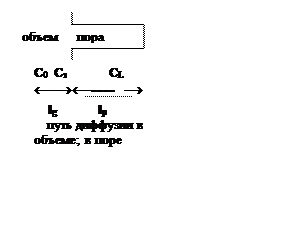
1/Т
Рис. 6.7.Профили концентрации в областях протекания гетерогенного каталитического процесса
|
обл. |
Градиент С |
Эффективность катализатора |
|
1 |
Мал, до 3% С = Сп ~ СL |
Около 100% |
|
2 |
В объеме мал; в поре большой |
10-90%, часть пор не работает |
|
3 |
В объеме большой; в поре очень больш. Сп ~0 |
около 1%; реакция идет на внешней поверхности катализатора |
|
4 |
очень большой в объеме и порах Сп= 0 |
реакция идет в газовой фазе |
6.3.4 Диффузионные стадии катализа
Сначала рассмотрим диффузионные области протекания катализа. В случае быстрой реакции на поверхности катализатора суммарная скорость процесса может быть ограничена скоростью диффузионного подвода из ядра потока к внешней поверхности катализатора. Скорость диффузии вещества в стационарном состоянии определяется уравнением Фика:
J = β∆C, (6.14)
где β=D/δ ; δ – толщина приведенной пленки и ∆C градиент (разность) концентраций между ядром потока и вблизи поверхности. Коэффициент массопередачи β является функцией от размера частиц, коэффициента диффузии, скорости потока и вязкости среды,
Рассмотрим случай, когда реакция на поверхности имеет 1й порядок по реагенту А (это справедливо, когда поверхностная концентрация вещества мала, т.е. заполнение поверхности bAPA << 1. В стационарном состоянии скорости диффузии и реакции равны, т.е. J = r или:
β(Cо- Сп) = k bCп (6.15)
Из (16) можно найти Cп = βCо/(kb + β) (6.16)
Подставляя это значение Сп в кинетическое уравнение, получим:
r = kbβCо/(kb + β) = kэфCо (6.17)
где kэф = kbβ/(kb + β) (6.18)
Уравнение 19 часто интерпретируют, как метод сложения сопротивлений (по аналогии с электрическим током), т.е. суммарное сопротивление слагается из диффузионного и реакционного (на поверхности)
1/kэф =1/β + 1/kb (6.19)
Из (18) очевидны 2 предельных случая:
1й : kb >> β и r = βCо , (6.20)
Такая область называется внешнедиффузионной, и
2й: kb << β, тогда
r = kbCо (6.21)
Эта область называется внешнекинетической.
Далее более подробно рассмотрим процесс диффузии в порах и реакцию n-го порядка, протекающую внутри поры. Поверхность считается плоской, и диффузия идет только по нормали (x) от поверхности внутрь пористой массы.
В стационарном состоянии скорость накопления вещества (определяется по 2-му закону Фика) равна скорости реакции:
Dэ(d2C/dx2) - kэCn= 0 (6.22)
Из решения д.у. (23) находится величина dC/dx и тогда можно рассчитать диффузионный поток, который равен наблюдаемой скорости реакции:
JD = ![]() (6.23)
(6.23)
Из этого уравнения видно, что наблюдаемая скорость реакции пропорциональна среднему геометрическому из скорости реакции и скорости диффузии.
В этой задаче естественным масштабом длины является
величина (Dэ /kэCn-1)0,5, которую называют эффективной глубиной проникновения
реакции в слой пористого материала L. Для реакции 1-го порядка L=![]() (Dэ /kэ)0,5. Очевидно, что чем
больше скорость реакции, тем меньше глубина проникновения реакции в пористый
материал.
(Dэ /kэ)0,5. Очевидно, что чем
больше скорость реакции, тем меньше глубина проникновения реакции в пористый
материал.
6.3.5 Адсорбционные стадии катализа
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.