6. Катализ
6.1 Основные принципы каталитического действия
Из кинетики нам известны два способа регулирования скорости реакции: за счет изменения температуры (по уравнению Аррениуса) и за счет изменения концентрации (по уравнению действующих масс). Однако существует самый эффективный способ регулирования скорости реакции за счет добавления катализатора, т.е. осуществление каталитической реакции.
Наиболее часто катализатор ускоряет наблюдаемую скорость реакции, что называется положительным катализом, однако известны случаи отрицательного катализа (например, когда катализатор ускоряет распад активированных комплексов). В дальнейшем, мы будем рассматривать только случай положительного катализа.
Дадим феноменологическое определение катализа: это явление изменения скорости реакции под влиянием специфического вещества – катализатора. Катализ осуществляется в результате многократного циклического взаимодействия катализатора с реагентами с образованием неустойчивых промежуточных соединений, которые распадаются с выделением продукта реакции и химически неизменного катализатора.
Создается впечатление, что катализатор обладает «некой магической силой» (Берцелиус. 1837), под действием которой реакция ускоряется и можно даже получить выигрыш энергии. Однако это не так.
Катализ представляет собой кинетическое явление, поскольку катализатор не изменяет положение равновесия и ускоряет термодинамически разрешенную реакцию как в прямом, так и в обратном направлении. Таким образом, катализатор не влияет на равновесие процесса, а только ускоряет достижение равновесия.
Большинство химических превращений в природе осуществляются с участием катализаторов-ферментов, например, фотосинтез, обмен веществ у млекопитающих и др. В химической промышленности более 90% продукции производится с участием катализаторов: это полимеры, жидкое и газообразное топливо, продукты нефтехимии, серная кислота, аммиак и др.
Рассмотрим на примере гидрирования этилена, в чем причина явления катализа. Эта реакция в газовой фазе из-за высокой энергии активации, около 40 ккал/М, протекает очень медленно и при 500К скорость равна приблизительно 10-4 моль/л.ч. В присутствии платинового катализатора реакция протекает весьма быстро, 103 моль/(м2.ч), даже при комнатной температуре, т.е. kк >> kг.
kг
----→ С2H6
С2H4 +H2│ ↑ kк
↔ [С2H4PtH2]
Из зависимости скорости реакции от температуры было найдено, что энергия активации реакции на платине составляет 9,6 ккал/моль.
Таким образом, ясно, что основная причина каталитического эффекта заключается в снижении энергетического барьера, причем реакция протекает по иному пути (рис. 6-1), включающем координацию и активацию реагентов в виде промежуточного комплекса на катализаторе.
|
|
Рис. 6.1 Энергии активации реакции в газовой фазе Ег и на поверхности катализатора Ек |
|
Координата реакции |
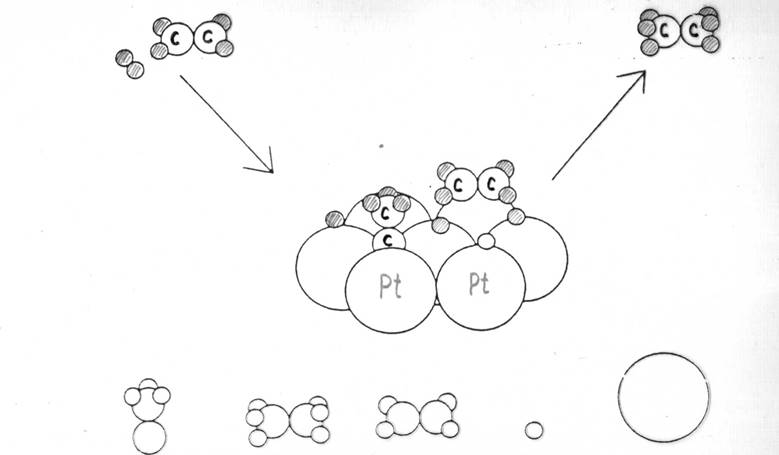
На рис. 6.2 показана схема механизма реакции гидрирования этилена на фрагменте платины (7 атомов). Эта схема включает образование как активного промежуточного комплекса на катализаторе типа [С2H4PtH2] (справа), так и неактивного комплекса типа [СH3С≡Pt3] (слева), приводящего к дезактивации катализатора.
По фазовому состоянию системы катализ может быть гомогенным, когда все компоненты находятся в одной фазе, и гетерогенным, когда катализатор находится в твердой фазе, а реагенты – в газовой или жидкой фазе. В особый класс выделяют ферментативный катализ.
По типу каталитических реакций различают радикальный катализ, когда катализатор инициирует образование радикалов и развитие цепи, как например, в случае окисления углеводородов в газовой (метан- формальдегид, катализатор НВг) или в жидкой фазе (парафины в жирные кислоты, катализатор Со3+); ионный катализ, например, процесс алкилирования аренов олефинами в присутствии кислот Льюиса. Кроме того, известен кислотно-основной, и окислительно-восстановительный катализ. Примером кислотно-основного катализа является гидратация олефинов в спирты в присутствии серной кислоты. К окислительно-восстановительному катализу относят процессы гидрирования и дегидрирования на переходных металлах и их оксидах и др.
|
Рис. 6.2. Схема реакции гидрирования этилена на платине
6.2. Гомогенный катализ
6.2.1. Газофазный катализ
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.