![]() (13)
(13)
Подставим выражения для частных
производных ![]() и
и ![]() в (12)
и (13):
в (12)
и (13):
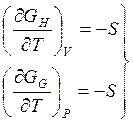 (14)
(14)
Получим:
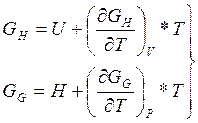 (15) уравнение Гиббса –
Гельмгольца.
(15) уравнение Гиббса –
Гельмгольца.
Внутренняя энергия U, свободная энергия Гельмгольца ![]() ,
свободная энергия Гиббса
,
свободная энергия Гиббса ![]() , энтальпия Н и энтропия
S – наиболее широко применяемые в термодинамике
характеристические функции. Они также называются термодинамическими
потенциалами. Через их производные можно явно выразить все термодинамические
свойства системы.
, энтальпия Н и энтропия
S – наиболее широко применяемые в термодинамике
характеристические функции. Они также называются термодинамическими
потенциалами. Через их производные можно явно выразить все термодинамические
свойства системы.
Из выражений (5), (9), (10),
(11) видно, что систему можно характеризовать не только через
характеристические функции U, ![]() ,
,
![]() и Н, но и через параметры состояния T, P, S, V если выразить их через характеристические функции, так,
например:
и Н, но и через параметры состояния T, P, S, V если выразить их через характеристические функции, так,
например:
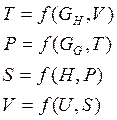
При формировании практически всех элементов ЭВС важную роль играют свойства, поверхности раздела отдельных слоев структуры или конструкции функциональных узлов, которые состоят из металлов, диэлектриков, полупроводников и композиционных материалов.
Свойства поверхности раздела зависят:
1. От сложных комплексных характеристик раздела на атомарном и субатомарном уровнях;
2. От взаимодействия этих поверхностей с полями (электрическими, электромагнитными) и излучениями (оптическими, ионизирующими).
Изменение характеристик поверхности раздела под действием внешних и внутренних факторов, приводит к необратимым изменениям параметров качества изделий ЭВС. Характеристики поверхностных и приповерхностных слоев влияют на все эксплутационные параметры ЭВС. Для установления количественных взаимосвязей параметров качества изделий и технологических факторов необходимо знание физико-химических свойств поверхности твердых тел. Это важно для выбора оптимальных технологических решений при эксплуатации и сохранении свойств поверхностных и приповерхностных слоев ЭВС. Любое технологическое воздействие среды на материал или изделие начинается с взаимодействия частиц этой среды с поверхностью материала, при этом необходимо знать механизм такого взаимодействия не только при формировании, но и при эксплуатации слоев. Технологии должны изучать явления и процессы, которые могут протекать на поверхности при различных условиях.
Адсорбция – это концентрирование вещества на поверхности раздела фаз.
Пусть мы имеем твердую поверхность на границе с газом (нанесение пленок на поверхность изолирующей подложки методом термовакуумного напыления). Внутри твердого тела частицы (атомы, ионы или молекулы) образующие его кристаллическую решётку правильно чередуются в соответствии с его кристаллической структурой, их взаимодействия уравновешены. На поверхности кристалла взаимодействие частиц неуравновешенно, у поверхностных атомов не все валентные связи задействованы, за счет обрыва кристаллической решетки у поверхности, поэтому поверхность притягивает атомы из соседней газовой фазы, в результате газ адсорбируется на поверхности твердого тела.
Адсорбент – это вещество, на поверхности которого происходит адсорбция.
Адсорбат – поглощаемое из объемной фазы вещество.
Десорбция – это процесс отделения от поверхности ранее адсорбированного вещества.
Существует 2 вида адсорбции:
1. Физическая;
2. Химическая (хемиосорбция);
Физическая возникает за счет действия различных сил:
· дисперсионные силы – это силы, вызванные согласованным движением электронов в сближающихся атомах, за счет движения электронов по орбитам возникают флюктуации электронной плотности, отклонение этой плотности от средней, за счет чего возникают флюктуирующие диполи, вызывает натяжение молекул;
· электростатические силы (ориентационные) возникают при адсорбции полярных молекул несущих постоянные электростатические заряды (ионы, диполи);
· индукционные силы, обусловленные появлением в адсорбирующихся молекулах дипольных моментов наведенных зарядами поверхности или появлением дипольных моментов в адсорбенте наведенных адсорбирующимся молекулами – диполями.
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.