Спиновые моменты электронов взаимодействующих атомов S1 и S2 должны быть противоположно направлены.
Свойства веществ с ковалентной связью:
- энергия связи очень высока сотни кДж/моль;
- высокая прочность;
- высокая твердость;
- высокие теплоты плавления и сублимации;
- диэлектрики (отсутствие ионов);
- прозрачные в длинноволновой части спектра.
К материалам этой группы относятся: алмаз, кремний, германий, серое олово, висмут, сурьма, йод и т.д.
В металлах в процессе кристаллизации при сближении атомов на порядок расстояния постоянной кристаллической решетки валентные электроны становятся свободными и обобществленными, в результате в пространстве между ионами образуется электронный газ, металлическая связь образуется за счет электростатического взаимодействия положительно заряженных ионов с отрицательно заряженным облаком электронного газа.
Металлическая связь высокоэнергетическая. Энергия связи порядка сотен кДж/моль. Поскольку связь высокоэнергетическая, материалы обладают высокой прочностью, твердостью, температурой плавления, теплотой сублимации.
В связи с тем, что в кристаллической решетке металлов содержится высокая концентрация электронов, они обладают высокой электропроводностью и теплопроводностью. Они обладают высокой отражательной способностью (блеск), это результат высокой концентрации свободных электронов.
Эти материалы обладают пластичностью – способностью изменять форму под влиянием механических нагрузок, не испытывая разрушений. Под влиянием механических усилий в металлах возникает скольжение по кристаллографическим плоскостям, при этом металлическая связь рвется и тут же восстанавливается, так как свободные электроны обобществлены и не принадлежат отдельным атомам.
Низкоэнергетическая связь,
порядка единиц и десятка кДж/моль, создается за счет сил Вандервальса. Такой
тип связи создают молекулы с насыщенными химическими связями: ![]() ,
, ![]() ,
, ![]() , атомы инертных газов. Так как
связь низкоэнергетическая – вещества малоустойчивы, летучи, температура
плавления мала, прозрачны.
, атомы инертных газов. Так как
связь низкоэнергетическая – вещества малоустойчивы, летучи, температура
плавления мала, прозрачны.
Имеем две частицы на расстоянии t друг от друга. Взаимодействие этих частиц
характеризуется потенциальной энергией. При сближении частиц действуют и силы
притяжения и силы отталкивания: ![]() .
.
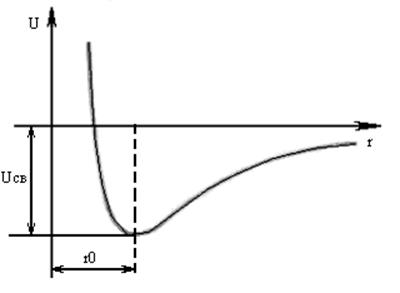
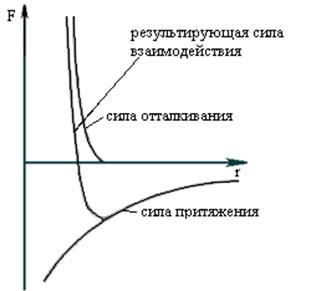
Если t=а, то ![]() , это более выгодное
состояние с энергетической точки зрения. Если перенести эти рассуждения на
большое количество частиц, то окажется, что система будет находиться в равновесии
и обладать минимумом потенциальной энергии, если частицы будут находиться на
строгом расстоянии друг от друга.
, это более выгодное
состояние с энергетической точки зрения. Если перенести эти рассуждения на
большое количество частиц, то окажется, что система будет находиться в равновесии
и обладать минимумом потенциальной энергии, если частицы будут находиться на
строгом расстоянии друг от друга.
Большинство полупроводниковых материалов представляет собой кристаллические твердые вещества с упорядоченной периодической структурой.
 Наименьший объем
кристаллического вещества, перемещением которого вдоль трех независимых
направлений можно получить весь кристалл, называют элементарной ячейкой.
Наименьший объем
кристаллического вещества, перемещением которого вдоль трех независимых
направлений можно получить весь кристалл, называют элементарной ячейкой.
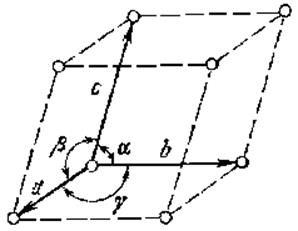
Кристаллографические оси в
кристалле определяют направление ребер элементарной ячейки, а система трех
векторов а, в, с (![]() ), образующая ячейку – базис.
), образующая ячейку – базис.
Расстояние между двумя соседними атомами вдоль одного из направлений решетки определяет постоянную решётки.
Кристаллы состоят из атомов или ионов, занимающих определенные положения в пространстве, условно называемые узлами пространственной решётки.
Существует семь простейших кристаллических систем (сингонии, типов симметрии) пространственных решёток.
Они отличаются длинами базисных векторов и углами между ними.
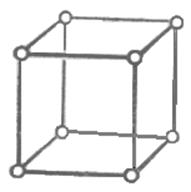
1) кубическая сингония а1=а2=а3; a=b=g=90о.
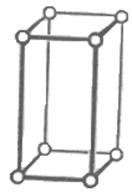
2) тетрагональная сингония а1=а2¹а3; a=b=g=90о.
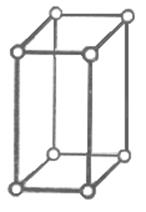
3) ромбическая сингония а1¹а2¹а3; a=b=g=90о.
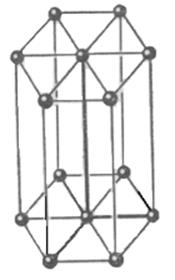
4) гексагональная сингония а1=а2¹а3; a=b=90о
g=120о
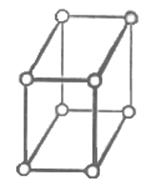
5) моноклинная сингония а1¹а2¹а3; a=b=g=90о¹g
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.