Из первого закона термодинамики нельзя определить возможность протекания процесса и его направление, что важно в конкретных случаях науки и техники.
Все процессы делятся на равновесные и неравновесные:
Равновесные процессы-процессы для течения которых не требуются затраты работы извне и в результате которых не может быть получена работа против внешних сил (передвижение шара по строго горизонтальной плоскости или качание маятника без трения).
Реальные процессы являются неравновесными.
Термодинамическая система, изменяясь, приближается к состоянию равновесия. С наступлением равновесия процесс заканчивается.
Существует два вида неравновесных процессов:
1. Неравновесные процессы, которые идут в направлении равновесия без воздействия внешней силы.
2. Обратные процессы, которые удаляют систему от состояния равновесия, и не могут идти без внешнего воздействия.
Процессы первого вида называются самопроизвольными или «положительными», процессы второго вида несамопроизвольными или «отрицательными».
В изолированной системе идут только положительные процессы, так как внешние воздействия исключены.
Второй закон термодинамики дает возможность предсказать направление хода процесса.
Существует две формулировки второго закона термодинамики:
Постулат Клаузиуса: - единственным результатом любой совокупности процессов не может быть переход теплоты от менее нагретой системы к более нагретой. Процесс теплопроводности необратим.
Постулат Томпсона: - теплота наиболее холодного тела из участвующих в круговом процессе не может служить источником работы. Самопроизвольный процесс превращения работы в теплоту (путем трения) необратим.
Второй закон термодинамики вводит новую функцию состояния системы энтропию - S.
Математическое выражение для энтропии можно записать следующим образом:
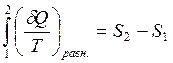
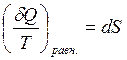
Энтропия – это функция состояния системы, изменение которой равно сумме приведенных теплот поглощенных системой в равновесном состоянии.
Это однозначная, непрерывная, конечная функция состояний.
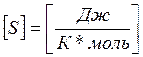 -
энтропийная единица.
-
энтропийная единица.
Рассчитав энтропию S можно предсказать направление процесса, если в изолированной системе для какого-либо процесса энтропия S возрастает, процесс может идти самопроизвольно, если энтропия S уменьшается, то процесс невозможен. Если S=const, процесс равновесен, система бесконечно близка к состоянию равновесия.
Для неизолированной системы, обменивающейся с окружающей средой теплотой и работой, возможны процессы, сопровождающиеся как увеличением, так и уменьшением S.
Для того чтобы решить однозначно вопрос о направлении процесса в неизолированной системе, необходимо включить в систему все тела участвующие в процессе, сделав систему изолированной.
Условие изолированной системы можно записать так: U=const, V=const.
Признак равновесия изолированной системы заключается в том, что изолированная система находится в состоянии равновесия, если S – системы имеет максимальное значение (S=Smax) при U=const, V=const.
Математически условие S=Smax записывается так:
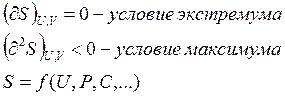
Третий закон термодинамики дает возможность вычислить абсолютное значение энтропии системы, с помощью постулата Планка:
Энтропия индивидуального идеального кристаллического вещества при абсолютном нуле равна нулю.
![]()
Для реальных кристаллов энтропия ![]() . Это подтверждено расчетами
статистической термодинамики. Это выражение справедливо и для температуры
абсолютного нуля, поэтому для реальных кристаллов
. Это подтверждено расчетами
статистической термодинамики. Это выражение справедливо и для температуры
абсолютного нуля, поэтому для реальных кристаллов ![]() .
.
Для идеального твердого тела:
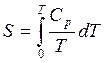 (1)
(1)
где ![]() -
теплоемкость данного вещества при постоянном давлении (P=const);
-
теплоемкость данного вещества при постоянном давлении (P=const);
T- температура.
Для большинства реальных
кристаллических веществ: ![]() ~
~![]() .
.
При Т®0 ![]() ®0 то есть
®0 то есть ![]() .
.
Было замечено, что при Т®0 к нулю стремиться не только S и ![]() , но и
объем тела и давление насыщенного пара изменяются с температурой так, что их
производные по температуре стремятся к нулю.
, но и
объем тела и давление насыщенного пара изменяются с температурой так, что их
производные по температуре стремятся к нулю.
Ни какие процессы не могут снизить температуру тела до абсолютного нуля – это принцип недостижимости абсолютного нуля.
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.