Механизм растворения определяется химической природой твердого тела и растворителя. Растворители могут иметь неорганическую природу (углеводы, спирты). Они различаются по химическому составу и концентрации. Скорость растворения обрабатываемой поверхности определяется этими факторами и температурой.
По современной теории существует 3 класса растворов, подчиняющихся определенным закономерностям: электролиты, неэлектролиты и металлические расплавы.
Электролиты обладают высокой электропроводностью s, высокой диэлектрической проницаемостью e. Молекулы компонентов растворов полярны. Свойственна электролитическая диссоциация молекул на ионы.
К электролитам относятся: практически все водные растворы солей, кислот, щелочей, а также расплавы солей.
Неэлектролиты обладают низкой электропроводностью s, низкой теплопроводностью и низкой диэлектрической проницаемостью e. Молекулы компонентов раствора нейтральны или незначительно полярны.
К неэлектролитам относят: большинство углеводородов и их производных.
Металлические расплавы обладают высокой электропроводностью, высокой теплопроводностью. Отсутствует электролитическая диссоциация молекул.
Растворы могут быть жидкие, твердые и газообразные.
Газообразные растворы называют смесями.
Каждый класс растворов хорошо растворяет вещества, принадлежащие к данному классу, и плохо растворяет вещества других классов. Например: углеводороды, растворяя большинство неэлектролитов, практически не растворяют водные растворы и металлы, а если растворяют то, как правило, в результате химического взаимодействия компонентов раствора с растворяемым веществом.
По характеру сил связи твердые кристаллические вещества делятся на 4 группы:
1. Ионные кристаллы – преобладающий тип ионная связь;
2. Атомные кристаллы – ковалентная связь;
3. Металлические кристаллы – металлическая связь;
4. Молекулярные кристаллы – за счет сил Вандервальса.
Ионная связь: в 1916 году Коссель создал теорию ионной связи.
Атом с малым числом электронов отдает их атому с большим числом электронов для завершения электрических пар. В результате получаются ионы с противоположными знаками, которые притягиваются.
В классической физике была рассчитана потенциальная энергия притяжения ионов.
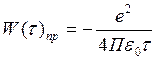 (1)
(1)
е – заряд взаимодействующих ионов;
t - расстояние между ними.
Нельзя ограничится только учетом действия сил притяжения, для установившегося состояния силы притяжения должны уравновешиваться силами отталкивания, существует определенное расстояние, на котором силы притяжения равны силе отталкивания. В классической физике потенциальную энергию отталкивания можно рассчитать только имперически:
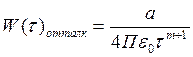 (2)
(2)
где а и m – const определяемые экспериментально.
Тогда полная потенциальная энергия:
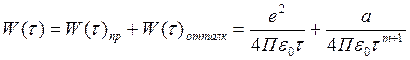
Ионная связь высокоэнергетическая. Энергия связи от сотен до тысяч кДж/моль.
Свойства материалов обладающих ионной связью:
- высокая прочность;
- высокая твердость;
- высокие температуры плавления;
- высокие теплоты сублимации.
С точки зрения электропроводности, она имеет ионную природу, ток образуется ионами и резко зависит от температуры.
С оптической точки зрения – это материалы прозрачные в широком диапазоне длин волн.
Ковалентная связь: была разработана Льюисом.
Объединяются одинаковые атомы ![]() или разнородные
или разнородные ![]() .
.
В 1927 году Гейтлер и Лондон провели расчет для системы из двух атомов водорода (Н).
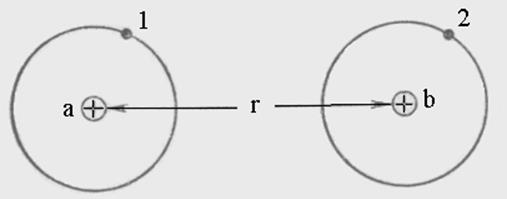
Плотность электронных облаков.
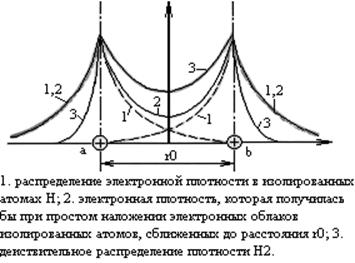
Электронные облака взаимодействующих атомов втягиваются в пространство между атомами. Ковалентная связь возникает за счет сил электростатического притяжения стягивающих положительные ядра атомов. Ядра стягиваются отрицательно заряженным электронным облаком высокой плотности в пространство между ядрами.
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.