Свойства простых эфиров весьма ограничены. Их очень часто используют в качестве растворителей (например, при получении реактивов Гриньяра). Избыток электронной плотности на эфирном кислороде приводит к появлению нуклеофильных и основных свойств. Основность простых эфиров очень мала, оксониевые соли образуются исключительно в безводной среде и устойчивы только при пониженных температурах.
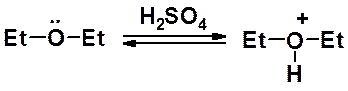
Алкиловые эфиры образуют устойчивые комплексы с кислотами Льюиса. Комплексы с трифторидом бора используют для получения борфторида триэтилоксония – очень мощного алкилирующего агента. С его помощью алкилируют соединения с самой низкой реакционной способностью.
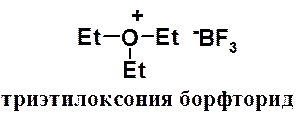
Основность эфиров проявляется в способности избирательно образовывать комплексы с металлами. С этой целью используют макроциклические полиэфиры – краун-эфиры (англ. crown – корона).
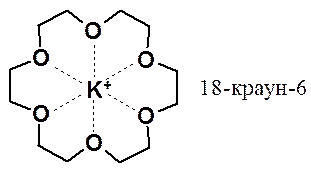
Использование краун-эфиров позволяет растворять в неполярных органических растворителях высокополярные неорганические вещества и проводить невозможные в других условиях реакции.
Алкиловые простые эфиры вступают в весьма ограниченный круг реакций. Чаще всего их используют в качестве растворителей (см. например получение реактивов Гриньяра). Наиболее препаративно важная реакция алкиловых эфиров – расщепление (ацидолиз), который обычно проводят действием йодистовдородной кислоты.
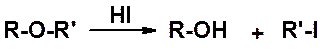
Если оба заместителя первичные – галоген оказывается у меньшего по размеру (SN2), если один из заместителей первичный, а второй третичный, галоген – у третичного (SN1).
Неприятное свойство эфиров – способность к окислению под действием кислорода воздуха при комнатной температуре. Образующиеся в результате окисления гидропероксиды очень взрывоопасны. Перегонка простых эфиров требует скрупулезного выполнения правил техники безопасности.
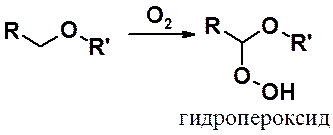
Очень широки синтетические возможности оксиранов, которые легко вступают в реакции с нуклеофилами с раскрытием цикла.
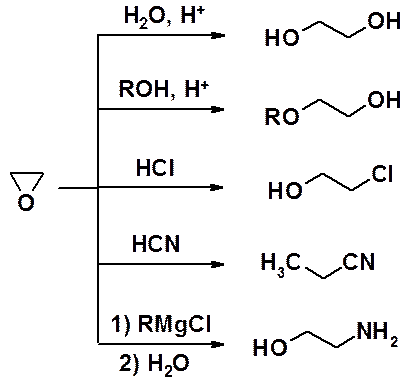
Кислород и сера находятся рядом в периодической системе элементов и имеют много общего. Серусодержащие органические соединения играют важную роль в процессах жизнедеятельности. Они входят в состав белков, ферментов, многих лекарств, красителей и др.
Тиолы (меркаптаны, тиоспирты) – соединения, в которых SH-группа связана с насыщенным атомом углерода (Alk-SH).
Тиофенолы - соединения, в которых SH-группа связана с ароматическом циклом (Ar-SH).
Сульфиды (тиоэфиры) – соединения, которых два углеводородных радикала связаны через атом серы (R-S-R’).
Первичные тиолы чаще всего получают нуклеофильным замещением галогена в соответствующих производных.
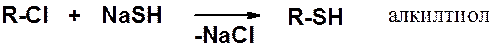
Вторичные галогенопроизводные реагируют с низким выходом, третичные в этих условиях образуют алкены.
Похожая реакция возможна среди галогеноаренов, при условии, что в кольце находятся активирующие атом галогена к реакции с нуклеофилами заместители.
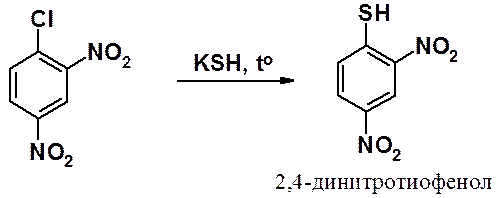
Получение тиолов реакцией алкилгалогенида с гидросульфидом натрия возможно только в присутствии большого избытка NaSH. Если в избытке органическое соединение результат – сульфид.
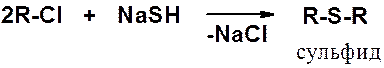
Наиболее общий способ получения сульфидов – реакция тиолов с галогенопроизводными.
![]()
Тиолы проявляют кислые свойства. pKa Алкантиолов – 10-11, тиофенолов – 6-8, что на пяти порядков вышем чем у соответствующих спиртов и фенолов. Повышенная кислотность тиопроизводных обусловлена тем, что тиоксидный анион (RS-) вследствии высокой поляризуемости атома серы более стабилен, чем алкоксидный (RO-).
В реакциях со щелочами тиолы образуют тиоляты, которые в водной среде заметно гидролизованы.
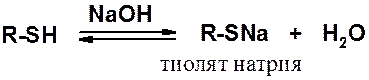
С тяжелыми металлами тиолы образуют нерастворимые ковалентные соли.
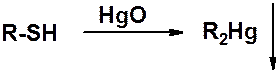
Это свойство используется при острых отравления тиоловыми ядами – веществами способными взаимодействовать с SH-группой (ртуть, хром, мышьяк и др.).
Тиолы, в особенности тиолят-анионы, и сульфиды проявляют выраженные нуклеофильные свойства. Реакции с электрофилами часто проходят в очень мягких условиях.
Тиолы и тиофенолы в присутствии оснований легко вступают в реакции алкилирования и арилирования с образованием сульфидов.
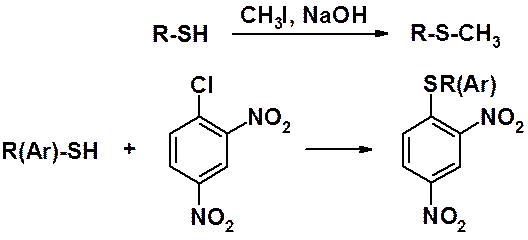
В щелочной среде тиолы реагируют с ангидридами и хлорангидридами карбоновых кислот с образованием эфиров тиокислот – аналогов сложных эфиров.
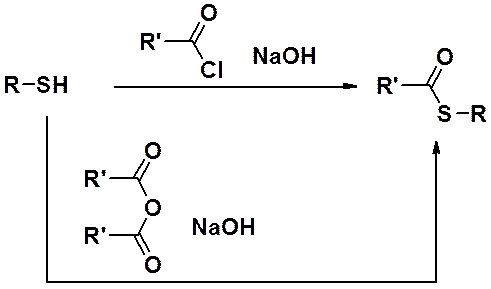
Тиолы значительно легче, чем спирты вступают в реакции окисления. В мягких условиях (действие О2 возд., Н2О2, I2 и др.) образуются дисульфиды – тиоаналоги пероксидов.
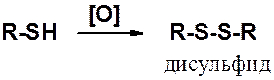
Связь S-S слабая, но намного прочнее пероксидной (О-О). Поэтому дисульфиды легко восстанавливаются (Н., КН, NaHSO3) в тиолы.
Жесткое окисление тиолов (с помощью KMnO4, HNO3 и др.) приводит к сульфиновым кислотам, которые в условиях реакции окисляются до сульфоновых кислот.

Сульфиды также способны к окислению мягкими окислителями.
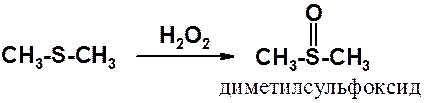
Так получают диметилсульфоксид (ДМСО) - превосходный растворитель, особенно хорошо сольватирующий ионы, что приводит к ускорению многих органических реакций. Часто используется как компонент косметики и лекарственных средств.
В результате восстановления тиолов образуются углеводороды.
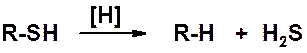
Тиолы обладают очень неприятным запахом. Метантиол (метилмеркаптан CH3SH) добавляют к бытовому газу (не пахнет), чтобы можно было обнаружить его утечку. Человеческий нос чувствует метантиол в концентрациях менее 10-9 моль/л.
Среди сульфидов наиболее известен бис(2-хлорэтил)сульфид – боевое отравляющее вещество, известное под названием иприт.
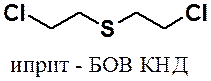
Альдегиды и кетоны
· Классификация, изомерия, номенклатура. Строение карбонильной группы. Сравнение связей C=O и C=C. Физические свойства карбонильных соединений, спектральные характеристики.
· Методы синтеза карбонильных соединений: окисление и дегидрирование спиртов, озонолиз и окисление алкенов, оксосинтез, гидратация алкинов, гидролиз геминальных дигалогеналканов, пиролиз солей карбоновых кислот, из нитрилов и реактивов Гриньяра, окислением метиларенов, ацилированием аренов, из фенолов и хлороформа.
· Химические свойства альдегидов и кетонов. Сравнение реакционной способности альдегидов и кетонов в реакциях нуклеофильного присоединения.
Альдегиды и кетоны
Карбонильные соедининения – органические вещества, в молекуле которых есть
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.