· Реакции элиминирования Е1, Е2. Факторы, влияющие на направление реакции (природа галогена, строение углеводородного остатка, природа нуклеофила и растворителя). Конкуренция процессов Е2 и SN2, Е1 и SN1. Реакции элиминирования как метод синтеза алкенов, алкинов и диенов.
· Галогенопроизводные со связью С(sp2)-галоген.
· Галогеналкены. Получение из дигалогеналканов и алкинов. Строение. Винилгалогениды - галогенопроизводные с пониженной реакционной способностью. Причины низкой подвижности атома галогена. Реакции в углеводородном радикале (присоединение, использование в качестве мономеров).
Уже известный метод получения алкенов – отщепление молекулы галогеноводорода от галогеопроизводных:
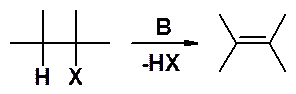
Элиминирование, как и нуклеофильное замещение, может проходить по двум механизмам: Е1 и Е2. Цифры означают не порядковый номер, а порядок реакции, т.е. соответственно моно- и бимолекулярное элиминирование.
Поскольку реакция бимолекулярная – ее скорость зависит от концентрации обоих реагентов – алкилгалогенида и основания. Это одностадийный процесс:
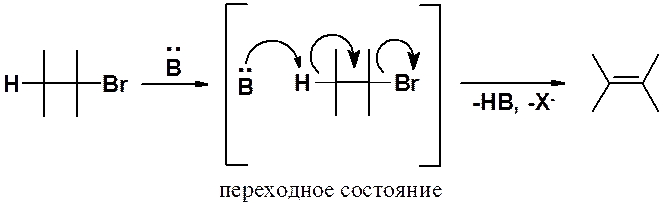
В активированном комплексе основание атакует своей электронной парой протон, находящийся в b-положении к атому галогена. По мере образования связи H-B, пара электронов связи С-Н перемещается в пространство между a- и b-углеродами с образованием p-связи и выбрасывается анион брома. Процесс согласованный. Реакция Е2 возможна только если связи, разрывающиеся в активированном комплексе, расположены транс. Это абсолютное требование к строению субстрата, участвующего в бимолекулярном элминировании.
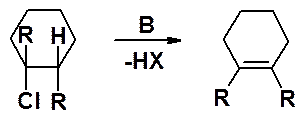
Здесь транс- относится не к геометрии образующегося алкена, а к расположению связей в галогенопроизводном.
Если в реакции участвует вторичное или третичное галогенопроизводное, возможно образование двух или трех алкенов. Региоориентация элиминирования определяется устойчивостью, образующегося непредельного соединения. Наиболее устойчив алкен, имеющий большее число заместителей при двойной связи (можно использовать и правило Зайцева).
Скорость мономолекулярного элиминирования зависит только от концентрации галогеноалкана и не зависит от концентрации основания. Реакция похожа на SN1 и часто они конкурируют. Первые стадии одинаковы:
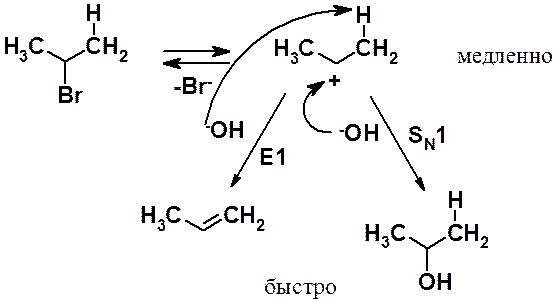
Механизм Е1 отличается от SN1 только тем, что в быстрой стадии происходит не взаимодействие карбокатиона и нуклеофила, а быстрее происходит отщепление основанием протона в a-положении и освободившаяся пара электронов образует двойную связь.
Доказательства механизма Е1:
· кинетика (первый порядок);
· нет стереохимических ограничений;
· реакция сопровождается перегруппировками (как SN1).
Поскольку существует огромное число субстратов, нуклеофилов, растворителей, температурных и др. условий проведения реакций, не всегда удается однозначно предсказать, что произойдет в результате атаки нуклеофила (основания) на алкан, несущий потенциальную уходящую группу. Ниже изложены закономерности общие не только для замещения или отщепления галогена, а для всех реакций нуклефильного замещения и элиминирования.
1. сильные основания (-NH2, RO-) способствуют элиминированию в большей степени, чем замещении. Предпочтительно элиминирование по Е2 по сравнению с Е1;
2. хотя относительная активность уходящих групп в реакциях SN и Е различается мало, отщепление некоторых групп (-+OH2 и -+N2) проходит предпочтительно по Е1;
3. в более полярных растворителях предпочтительно протекание SN2 реакций, по сравнению с Е2 (реакция замещения – раствор щелочи в воде, элиминирования – раствор щелочи в спирте);
4. карбокатионы неизменно образуют больше продукта замещения, чем элиминирования, причем это соотношение невозможно изменить, варьируя растворитель;
5. повышение температуры всегда увеличивает образование продукта элиминирования за счет замещения;
6. для получения алкенов обычно используют Е2 реакции, т.к. Е1 сопровождаются перегруппировками.
Галогенопроизводные обычно подразделяют на три группы:
· с нормальной (обычной) реакционной способностью – алкилгалогениды;
· с повышенной реакционной способностью – аллил- и бензилгалогениды;
· с пониженной реакционной способностью – галогенопроизводные со связью С(sp2)-галонен – винил- и арилгалогениды.
Галогеноалкены (винилгалогениды) – соединения, в молекуле которых атом галогена находится у углерода, связанного двойной углерод-углеродной связью.
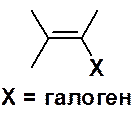
Винилгалогениды получают присоединением одной молекулы галогеноводорода к тройной связи или отщеплением одной молекулы галогеноводорода от вицинального или геминального дигалогеноалкана.
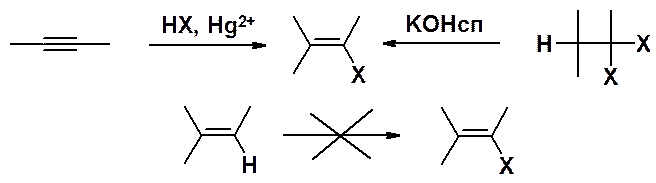
Непосредственное замещение водорода на галоген в алкенах невозможно!
Галогеноалкены относят к галогенопроизводным с пониженной реакционной способностью.
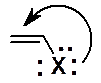
Объяснение такому отнесениию в том, что атомы галогенов богаты электронами. Между двойной углерод-углеродной связью и галогеном всего одна простая С-С связь, т.е. система сопряженная. Именно за счет сопряжения электронная плотность галогена частично сдвинута в сторону двойной связи. Длина связи С(sp2)-галоген значительно меньше, а энергия, соответственно, больше, чем связи С(sp3)-галоген. Говорят, что связь С(sp2)-галоген имеет характер частично двойной связи.
Повышенная прочность связи углерод-галоген в галогеноалкенах определяет их низкую реакционную способность.
Для целей настоящего курса необходимо запомнить, что галогеноалкены не способны вступать в реакции:
· нуклеофильного замещения (SN1 и SN2)
· с металлами (реакции Вюрца и Гриньяра).
Винилгалониды способны вступать в реакции присоединения (см. алкены и алкины) и полимеризации.
Полимеризация хлорэтилена приводит к широко используемому полимеру – поливинилхлориду:
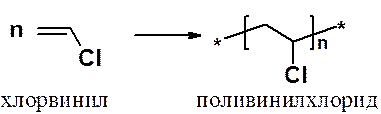
а хлоропрена – к хлоропреновому каучуку:
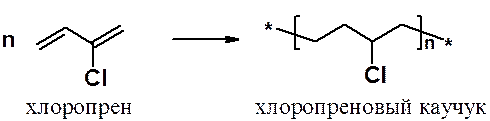
Галогенопроизводные со связью С(sp3)-галоген.
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.