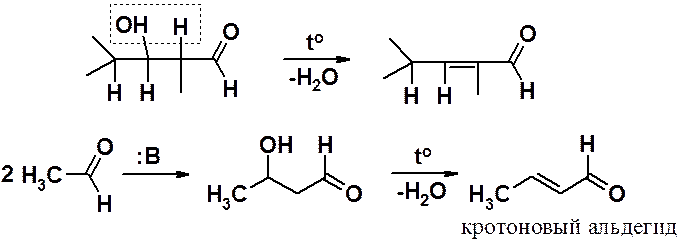
Поскольку простейший из альдегидов, способных вступать в альдольную конденсацию с последующей дегидратацией, образует в результате кротоновый альдегид – вся последовательность реакций получила название кротоновой конденсации. Последнюю стадию (дегидратацию) часто называют кротонизацией.
В условия кислого катализа остановить реакцию на стадии альдоля не удается. В присутствии кислоты может быть проведена только реакция кротоновой конденсации.
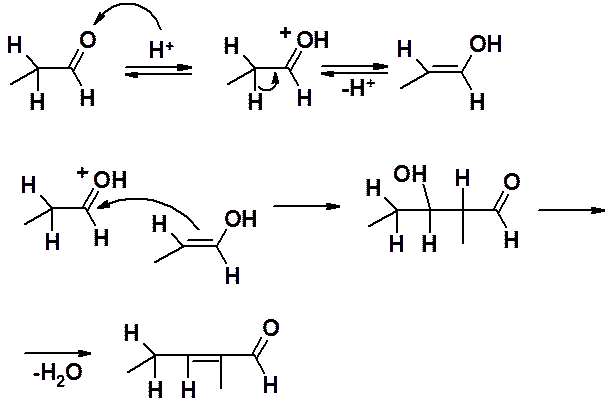
Кетоны вступают в реакцию конденсации с большим трудом, только в жестких условиях. Удовлетворительные результаты могут быть получены только при проведении реакции в кислой среде, т.е. только в условиях кротоновой конденсации. Следует помнить, что, поскольку у кетонов есть два a-углеродных атома, реакция может протекать по обоим реакционноспособным положениям.
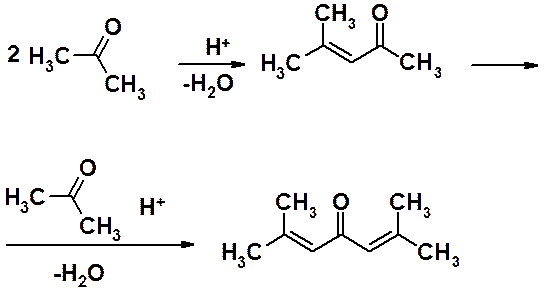
Перекрестныя конденсации – реакции, в которых участвуют различные карбонильные соединения. Не имеет препаративного смысла проводить перекрестные реакции с двумя альдегидами, содержащими a-водороды. В этом случае образуются четыре продукта реакции.
Обычно, перекрестную альдольную или кротоновую конденсации проводят с участием одного альдегида, имеющего водороды в a-положении, и другого, у которого они отсутствуют. Причем первый берут в недостатке, а второй в избытке.
Альдегид, содержащий a-водороды, служит источником енолят-аниона.
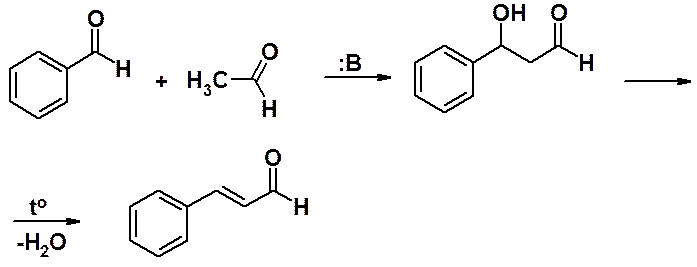
Известно много конденсаций по своему механизму близких к альдольной (Прекина, Кляйзена и др.). Все эти реакции включают стадию атаки карбаниона по углероду карбонильной группы. Карбанион образуется в результате отрыва основанием протона от a-углеродного по отношению к карбонильной группе атома альдегида, кетона, сложного эфира, ангидрида карбоновой кислоты и др. Хотя в этих конденсациях участвуют соединения разных классов, химия процессов в общем одинакова. Глубоко понимая механизм альдольной конденсации, легко разобраться и в остальных реакциях.
Реакция ароматических альдегидов с ангидридами карбоновых кислот, содержащих a-водород, приводит к непредельным карбоновым кислотам.
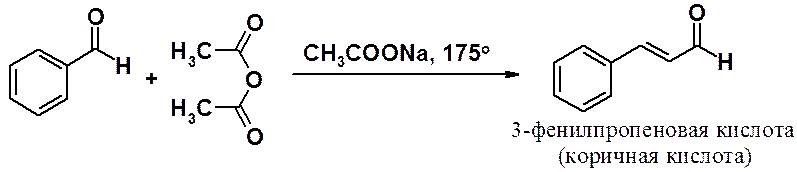
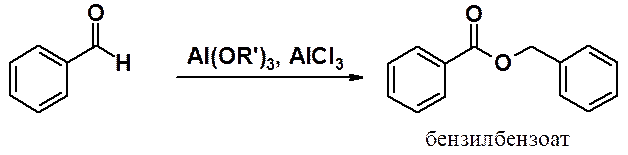
· Непредельные карбонильные соединения. Классификация, изомерия, номенклатура. Физические свойства и молекулярная структура кумулированных и сопряженных енонов (строение, сопряжение, распределение электронной плотности), спектральные свойства.
· a,b-Непредельные альдегиды и кетоны. Методы получения: окисление олефинов по аллильному положению и спиртов с гидроксильной группой в аллильном положении, кротоновая конденсация, дегидратация глицерина как метод получения акролеина.
· Химические свойства: каталитическое гидрирование, восстановление комплексными гидридами металлов, восстановление металлами в присутствии источников протонов, методы селективного восстановления С=С и С=О связей. Понятие о защитных группах и принципы их синтетического использования. Присоединение воды, спиртов, галогеноводородов, бисульфита натрия, аммиака и аминов, НСN, реактивов Гриньяра. Реакции конденсации с СН-активными соединениями (реакция Михаэля).
· Хиноны: методы получения, реакции восстановления и присоединения.
К этой группе относят соединения, в которых двойные связи углерод-кислород и углерод-углерод разделены одной простой С-С связью, т.е. содержат систему сопряженных двойных связей.
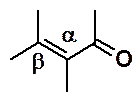
Ранее описаны два общих метода получения a,b-непредельных карбонильных соединений:
· кротоновая конденсация;
· получение a-галогенопроизводных с последующем дегидрогалогенированием.
Химические свойства непредельных и карбонильных соединений уже были рассмотрены (см. разделы «Алкены» и «Альдегиды и кетоны»). Следует помнить, что во многих случая для селективного проведения реакции по одной из функциональных групп, вторую необходимо защитить (см. выше).
В этом разделе рассматриваются реакции, характерные именно для a,b-непредельных карбонильных соединений.
Электронное строение сопряженного фрагмента:
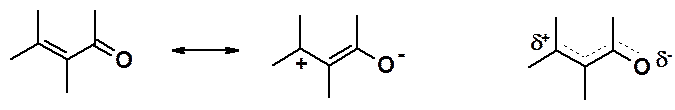
Четыре p-электрона делокализованы на четырех атомах углерода. Ацепторные свойства карбонильной группы приводят к появлению избытка электронной плотности на атоме кислорода и недостатка на b-углеродном атоме. Можно предсказать, что такое распределение электронной плотности приведет к дезактивации двойной связи в реакциях AE и активации в реакциях AN.
Электрофильное присоединение
Хотя реакции электрофильного присоединения идут формально против «правила Марковникова», ничего необычного в этих превращения нет. Они протекают через наиболее стабильный интермедиат (карбокатион).
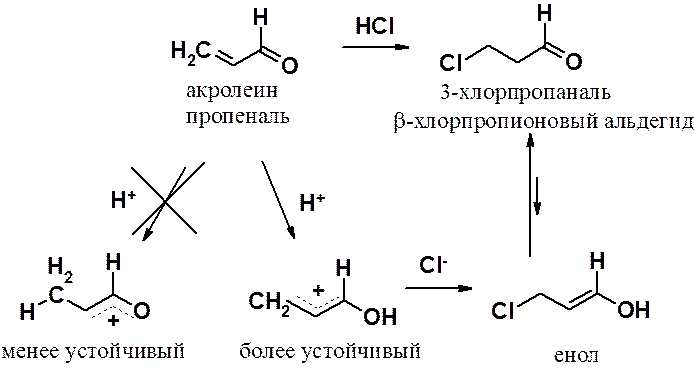
Нуклеофильное присоединение
К двойной связи a,b-непредельных карбонильных соединений легко присоединяются HCN, NH3 и другие нуклеофилы. Реакция идет через наиболее устойчивый промежуточный продукт – енолят-анион. Следует помнить, что присоединение нуклеофила к С-С двойной связи может осложняться реакцией по карбонильной группе.
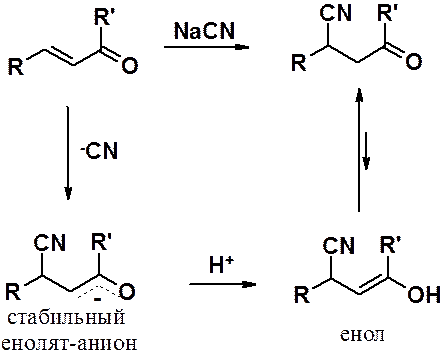
Реакция a,b-непредельных карбонильных соединений с карбанионами играет важную роль в синтезе полифункциональных веществ и называется реакцией Михаэля. Превращение протекает в присутствии основания и начинается с образования карбаниона (нуклеофила), после чего проходит обычная реакция нуклеофильного присоединения (см. предыдущую схему).
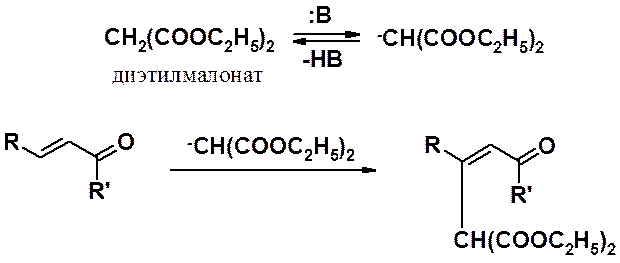
Циклические дикетоны с двумя двойными углерод-углеродными связями и двумя карбонильными группами называются хинонами. Их получают окислением незамещеных или дизамещенных ароматических производных.
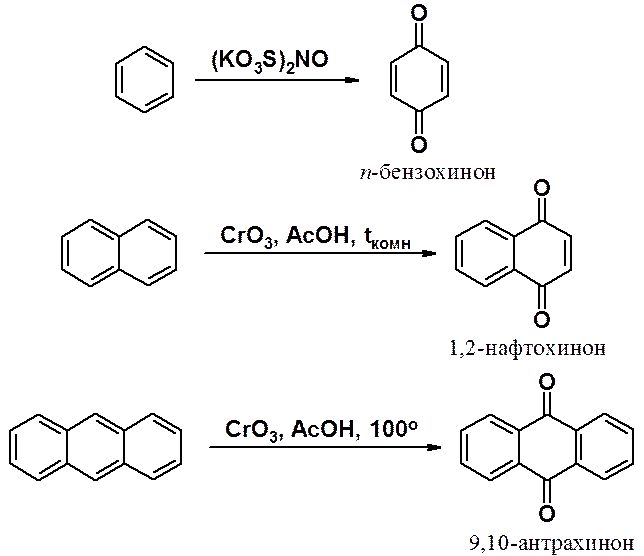
Наличие в хинонах сопряженной системы определяет наличие окраски. Так, п-бензохинон окращен в желтый цвет. Соединения этой группы играют заметную роль в процессах жизнедеятельности.
Химические свойства
Хиноны – сильные окислители. Сами хиноны легко восстанавливаются в гидрохиноны.
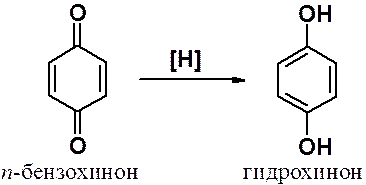
Типичные реакции – 1,4-присоединение, сопровождаемое ароматизацией.
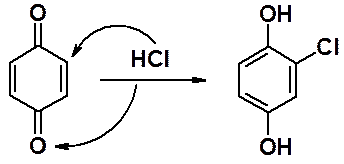
Хиноны – прекрасные диенофилы в реакциях Дильса-Альдера. Эти реакций часто являются первым шагом в синтезе сложных конденсированных полициклических веществ.
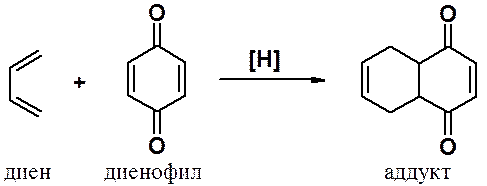
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.