Низшие альдегиды легко вступают в реакцию полимеризации за счет С=О связи. Так, формальдегид легко образует линейный полимер – параформальдегид (параформ) или циклические три- и третрамеры.
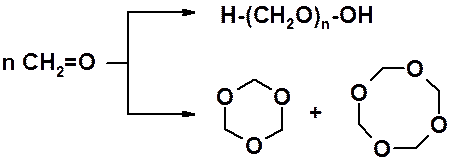
Ацетальдегид не образует линейный полимер, но также легко превращается в циклические три- и тетрамеры.
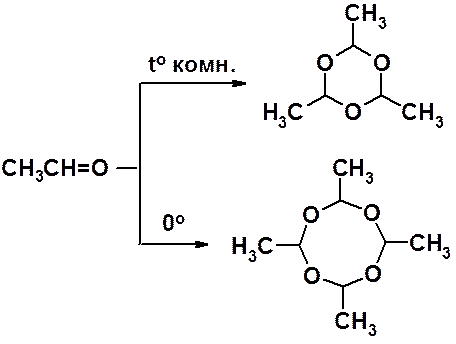
Альдегиды и кетоны
· Кето-енольная таутомерия, СН-кислотность карбонильных соединений, их галогенирование (механизм), галоформная реакция.
· Межмолекулярные реакции карбонильных соединений: альдольная и кротоновая конденсации, реакция Перкина, реакция Кляйзена-Тищенко. Механизм этих реакций. Окислительно-восстановительные реакции карбонильных соединений. Восстановление карбонильных соединений (по Клеменсену, Кижнеру-Вольфу, Меервейну-Понндорфу-Верлею). Окисление карбонильных соединений: Ag2O, СгO3, перкислотами (по Байеру-Виллигеру), аутоокисление. Реакция Канниццаро.
Действие на альдегиды и кетоны пятихлористого фосфора приводит к геминальным дигалогенопроизводным.
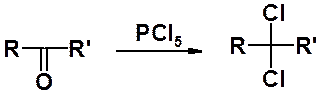
Окисление кетонов происходит в очень жестких условиях, поскольку требует разрыва С-С связи. Препаративное значение в ряду кетонов имеет окисление пероксикислотами (надкислотами), приводящее к сложным эфирам (реакция Байера-Виллингера, 1899 г.). Приемлемые результаты могут быть получены и при окислении пероксидом водорода.
В несимметричных кетонах легкость миграции углеводородного радикала уменьшается в ряду третичный > вторичный > первичный > метильный.
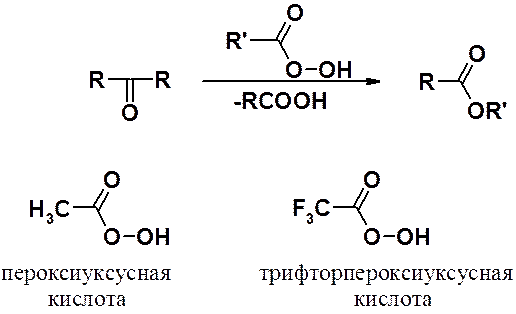
Альдегиды очень легко окисляются до карбоновых кислот почти любыми окислителями. Чаще всего в качестве окислителей используют KMnO4, K2Cr2O7, CrO3. Окисление оксидом серебра приводит к реакции «серебряного зеркала».
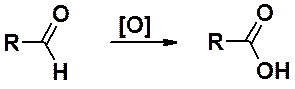
Альдегиды способны вступать в реакцию аутоокисления. В присутствии кислорода воздуха по цепному механизму окисляются до карбоновых кислот.
Восстановление карбонильных соединений до спиртов было рассмотрено ранее.
Альдегиды и кетоны могут быть восстановлены до углеводородов.
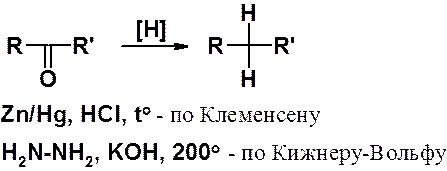
Восстановление может быть выполнено амальгамой цинка в соляной кислоте (по Клеменсену).
К аналогичному результату приводит восстановление гидразином в сильнощелочной среде при высокой температуре (по Кижнеру-Вольфу).
Альдегиды, у которых отсутствуют водороды в a-положении к карбонильной группе, при действии концентрированной щелочи превращаются в эквимолярную смесь спирта и карбоновой кислоты.
Гидроксид-анион, атакует углерод карбонильной группы с образованием годроксигидроксидного аниона. Последний теряет гидрид-ион (Н-) и превращается в карбоновую кислоту.
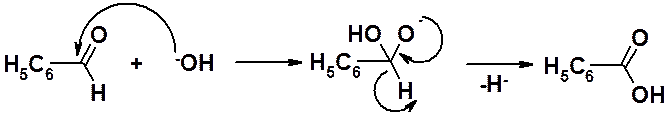
Образовавшийся гидрид-ион атакует другую молекулу альдегида. В результате образуется алкоксид-анион.
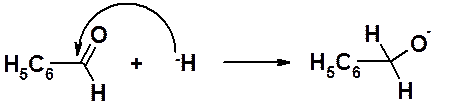
Поскольку алкоксидные анионы более сильные основания, чем щелочи, образовавшийся анион отрывает протон от кислоты, образуя в результате первичный спирт. Кислоту, образующуюся в это реакции, выделяют в виде соли.

Реакции анионов карбонильных соединений
Наличие в a-положении к карбонильной группе атома водорода создает предпосылки для кето-енольной таутомерии (см. раздел «Алкины»).
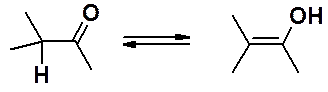
Если с карбонильной группой связаны углеводородные радикалы, равновесие всегда сильно сдвинуто в сторону кето-формы. Наличие акцепторных заместителей способно сдвинуть таутомерное равновесие в сторону енольной формы.
Водороды в a-положении к карбонильной группе альдегидов и кетонов обладают подвижностью, а соответствующие карбонильные соединения относят к СН-кислотам. Подвижность водорода связанного с sp3-углеродным атомом объясняется двумя факторами:
1. находящаяся рядом акцепторная карбонильная группа сдвигает к себе электронную плотность связи С-Н, в результате позитивированный водород может быть отдан основанию;
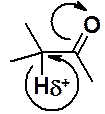
2. образующийся анион – енолят-анион - стабилизирован за счет сопряжения. Отрицательный заряд распределен по трем атомам (два углерода и кислород).
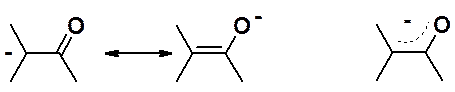
Енолы и енолят-анионы играют определяющую роль во многих интересных превращениях.
Водород в в a-положении к карбонильной группе может быть легко замещен на атом галогена. Чаще всего используют не хлорирование, а более селективное бромирование. Реакция может быть катализирована как кислотами, так и основаниями и имеет интересную особенность: скорость реакции не зависит от природы галогена. Следовательно: стадия, определяющая скорость реакции (лимитирующая) не включает образование связи углерод-галоген.
Катализ основаниями:
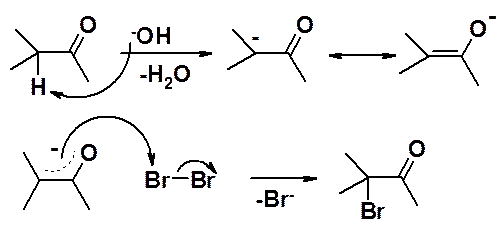
Катализ кислотами:
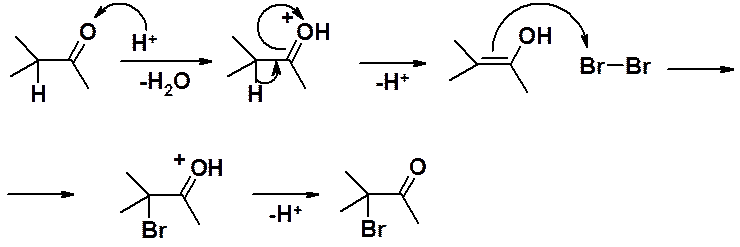
Ключевая стадия реакции отщепление протона от оксониевого катиона с образованием енола, которая облегчается протонированием карбонильного соединения.
Качественная реакция на метилкетоны и ацетальдегид – обработка карбонильного соединения избытком йода в присутствии щелочи. Выпадение желтого осадка указывает на наличие в исходном соединении метильной группы, связанной с карбонилом. Аналогичные реакции идут с хлором и бромом, но только реакция с йодом с йодом приводит к нерастворимому йодоформу.
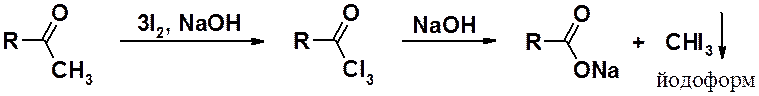
В реакцию вступают альдегиды у которых в a-положении к карбонильной группе есть хотя бы один атом водорода. Альдольная конденсация катализируется основаниями, причем чаще всего довольно слабыми, например, Ba(OH)2. Использование едких щелочей возможно только в некоторых случаях при проведении реакции при пониженной температуре.
Реакция начинается с атаки основанием на подвижный атом водорода в a-положении карбонильного соединения. Образуется резонансностабилизированный енолят-анион, который проявляет выраженные нуклеофильные свойства и атакует карбонильный углерод молекулы альдегида, не вступившей во взаимодействие с основанием. Образующийся алкоксид-анион протонируется, превращаясь в конечный продукт – альдоль.
Кетоны в этих условиях в реакцию не вступают.
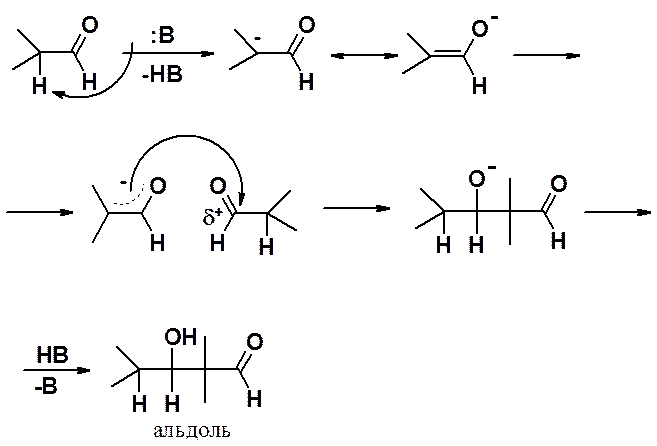
Альдоль может быть выделен из реакционной смеси в свободном виде. Однако реакция может протекать глубже. При незначительном нагревании (около 60о) альдоли легко отщепляют воду, превращаясь в непредельные альдегиды.
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.