Аллилфениловые эфиры фенолов термодинамически неустойчивы и при нагревании изомеризуются в устойчивые орто-аллилфенолы (перегруппировка Кляйзена).
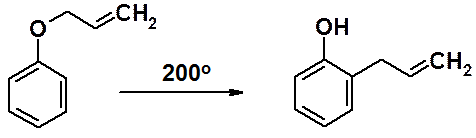
Образование сложных эфиров фенолов возможно только в реакциях с ангидридами или хлорангидридами карбоновых кислот, но не с сами кислотами.
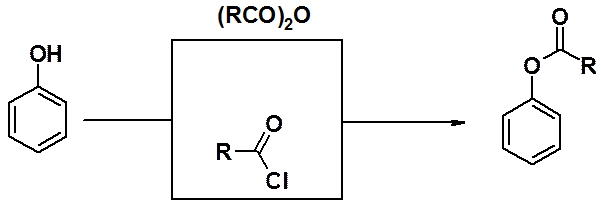
Сложные эфиры фенолов соединения термодинамически неустойчивые. В присутствии кислот Льюиса они вступают в перегруппировку Фриса. При температуре более 100о ацильная группа мигрирует в орто-, а при комнатной – в пара-положение.

Каталитическое восстановление фенола приводят к циклогексанолу – важному исходному соединению в синтезе искусственных волокон.
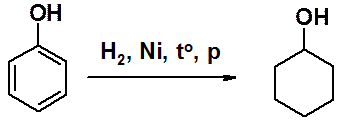
Фенолы окисляются уже при стоянии на воздухе, что объясняется повышенной, по сравнению с бензолом, электронной плотностью в цикле. Окисление фенола приводит к орто- и пара-хинонам, причем тщательным подбором условий удается провести селективное окисление. Значительно легче вступают в окисление с образованием соответствующих хинонов двухатомные фенолы.
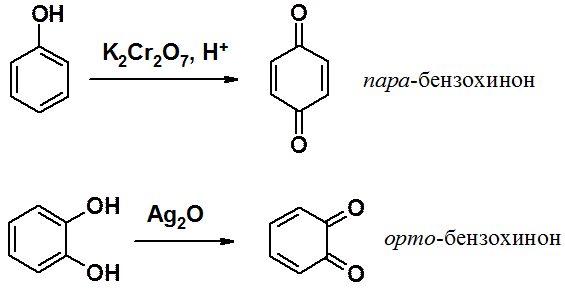
ОН-Группа – активирующий заместитель, орто-пара-ориентант. Активирующие свойства гидроксигруппы столь велики, что для получения монобромпроизводного исходным соединением является не фенол, а сложный эфир фенола. После бромирования ацильную группу гидролизуют.
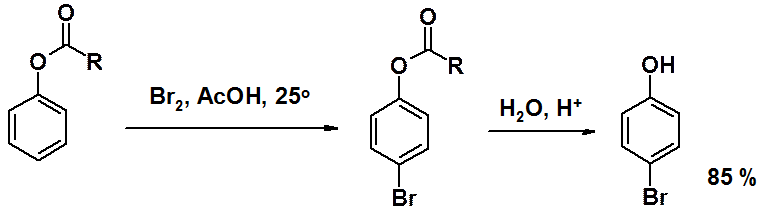
Реакция фенола с трехкратным избытком бромной воды останавливается только тогда, когда электрофил занимает все положения кольца, которые может атаковать.
В большем избытке бромной воды результатом реакции становится «тетрабромфенол». Таким образом, активирующее действие ОН-группы столь велико, что возможно протекание реакций с нарушением ароматической системы.
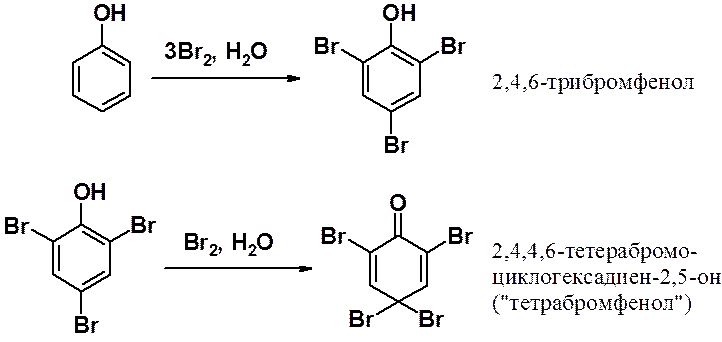
Нитрование фенола легко протекает при комнатной температуре разбавленной азотной кислотой. Образуется смесь орто- и пара-нитрофенолов, которую легко разделить перегонкой с водяным паром (более летучий орто-изомер перегоняется с водяным паром).

Строение продуктов сульфирования фенола сильно зависит от температуры и времени проведения реакции. Сульфирование при комнатной температуре приводит к кинетически контролируемому орто-изомеру, реакция при 100о к пара-изомеру - продукту термодинамического контроля. Обратимость сульфирования позволяет нагреванием превратить орто-изомер в продукт пара-замещения.
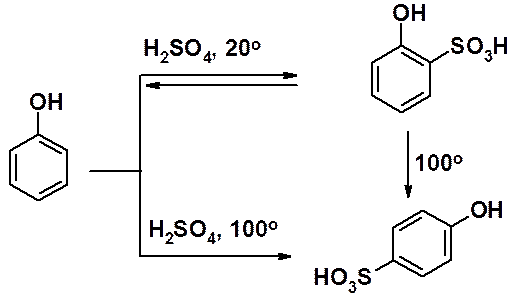
В фенольном ряду эти реакции имеют некоторые особенности, связанные с тем, что фенолы образуют комплексы с кислотами Льюиса и дальнейшая реакция алкилирования не происходит.
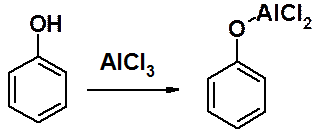
Поэтому сначала проводят О-алкилирование фенола, затем С-алкилирование или ацилирование по Фриделю-Крафтсу, после чего регенерируют ОН-группу.
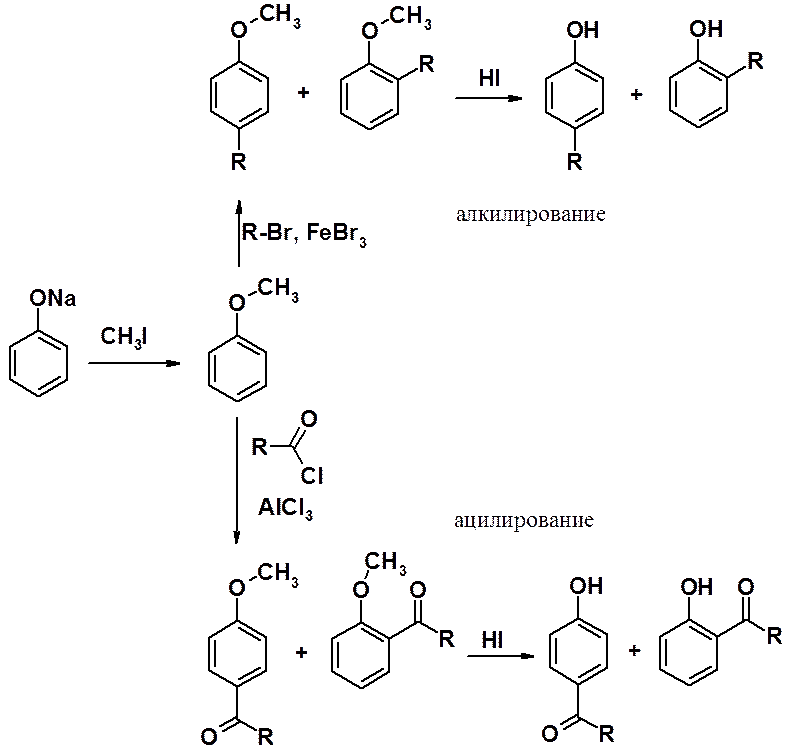
Известный индикатор – фенолфталеин – продукт ацилирования фенола фталевым ангидридом.
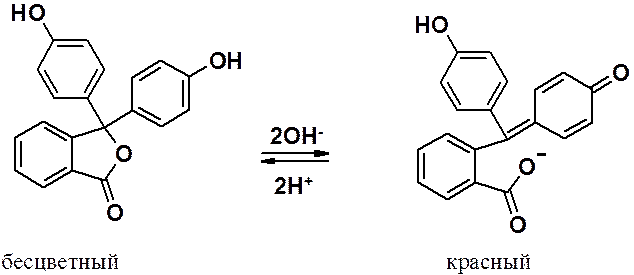
Активирующие свойства гидроксильной группы в фенолах столь велики, что позволяют осуществлять превращения, невозможные в бензольном ряду.
Фенолят-анионы способны вступать в реакцию ароматического электрофильного замещения со столь слабым электрофилом как оксид углерода IV (углекислый газ).
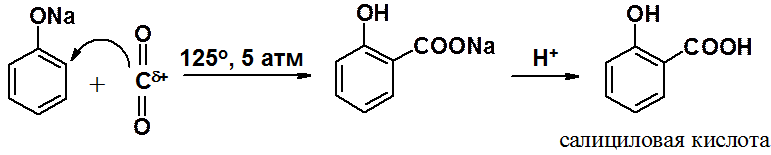
Реакция Кольбе-Шмитта промышленный метод получения салициловой кислоты, предшественника широко распространенного лекарства – ацетилсалициловой кислоты (аспирина).
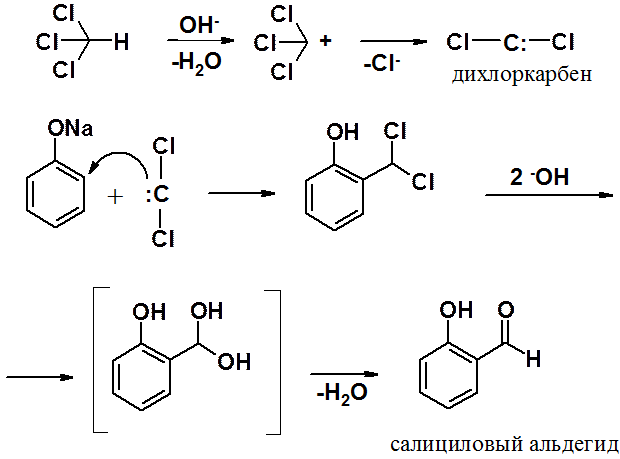
Нагревание фенола с хлороформом в присутствии щелочи приводит к введению в орто-положение бензольного кольца альдегидной группы. Электрофилом в этой реакции является дихлоркарбен (:ССl2), образующийся при взаимодействии хлороформа со щелочью. Далее проходит обычная реакция SEAr. В условиях реакции дихлорбензильное производное гидролизуется, затем отщепляет молекулу воды, превращаясь в альдегид.
· Диалкиловые эфиры. Классификация, изомерия, номенклатура. Физические свойства. Химические свойства: образование оксониевых солей, расщепление кислотами, автоокисление. Получение межмолекулярной дегидратацией спиртов и действием алкилгалогенидов на алкоголяты. Получение и применение в синтезе краун-эфиров. Виниловые эфиры. Получение, гидролиз и причины легкости его протекания, полимеризация.
· Простые циклические эфиры. Эпоксисоединения: получение, реакции с водой, спиртами, галогеноводородами, аммиаком и аминами, реактивами Гриньяра. Тетрагидрофуран, диоксан.
· Токсикологические свойства и техника безопасности при работе с простыми эфирами.
Тиоаналоги спиртов, фенолов и эфиров.
· Общая характеристика, номенклатура. Получение алкилтиолов реакцией алкилирования сероводорода и его солей. Получение арентиолов восстановлением аренсульфонилхлоридов. Физические свойства тиолов, полярность связи S-H. Кислотные свойства тиолов, реакции алкилирования и окисления. Диметилсульфоксид. Тиоэфиры (сульфиды), их получение, физические свойства. Реакции алкилирования и окисления тиоэфиров. Токсичность бис(2-хлорэтил)сульфида. Техника безопасности при работе с органическими соединениями серы. Антидоты.
Простыми эфирами называют соединения общей формулы R-O-R’, где R и R’ углеводородные радикалы. Простые эфиры бывают алифатическими, ароматическими, смешанными, симметричными и несимметричными, а также циклическими.
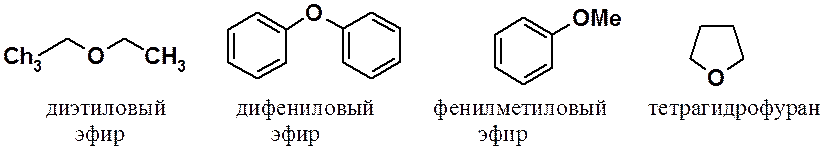
Некоторые способы получения эфиров: межмолекулярной дегидратацией спиртов, синтезом Вильямсона в спиртах и фенолах и присоединением спиртов к алкинам были рассмотрены ранее.
Часто используют методы, которые можно назвать «модифицированными синтезами Вильямсона», заключающиеся во взаимодействии алкоксид аниона с алкилирующими агентами. К наиболее распространенным алкилирующим агентам относятся диметилсульфат и эфиры пара-толуолсульфокислоты.
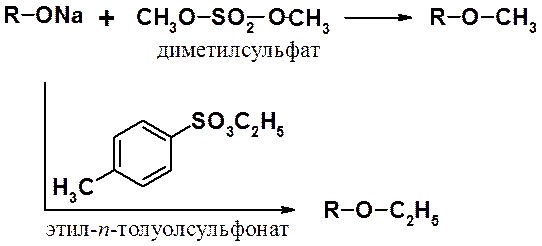
Эфиры могут быть получены также получены присоединением спиртов к алкенам в присутствии кислот Льюиса при нагревании и повышенном давлении.
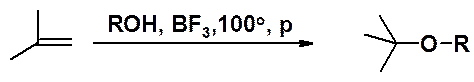
Получение оксиранов см. раздел «Алкены». Пяти- и шестичленные циклы с эфирным кислородом получают внутримолекулярной дегидратацией 1,4- или 1,5-диолов, соответственно.
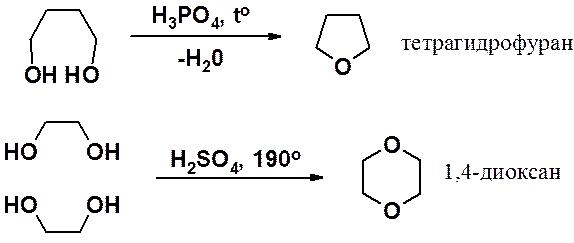
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.