При расположении донорной группы в орто- или пара-положениях, можно отметить две невыгодные граничные структуры, наличие которых позволяет сделать вывод о дестабилизационном влиянии донорной группы на анионный s-комплекс и уменьшении подвижности галогена. Наличие донора в мета-положении к галогену, выраженного дестабилизирующего действия они не оказывают. Некоторая дезактивация атома галогена вызывается только общим + I-эффектом.
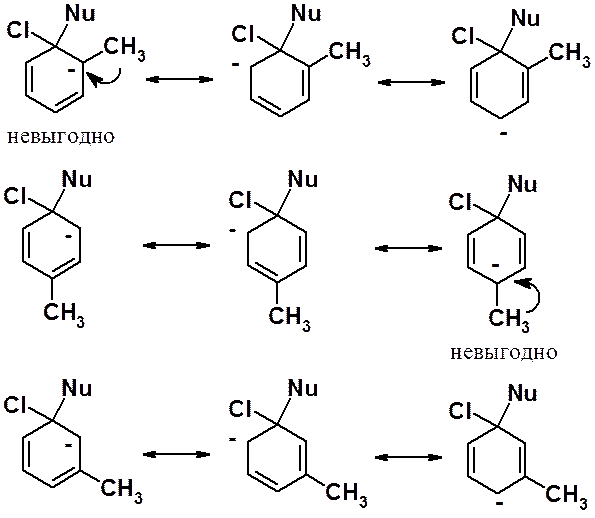
Увеличение числа акцепторных группировок приводит к большей стабилизации комплекса Мейзенгеймера, за счет уменьшения электронной плотности в бензольном кольца. Сам комплекс Мейзенгеймера – твердое устойчивое вещество красного цвета.
При наличии в молекуле нескольких донорных групп ситуация обратная.
Действие на галогеноарен амидом калия в жидком аммиаке приводит к продукту замещения. Эта реакция протекает по механизму «отщепления-присоединения» или «ариновому».
Первая стадия: отщепление амидным анионом протона в орто-положении к галогену с образованием бензониевого аниона.
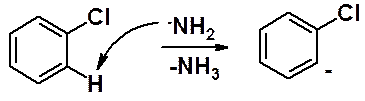
Бензониевый анион теряет анион галогена, формально превращаясь в диполярный ион, который за счет взаимодействия расположенных рядом орбиталей, мгновенно превращается в дегидробензол (бензин).

Дегидробензол (название бензин лучше не применять, чтобы избежать путаницы) крайне высоко реакционноспособное соединение. Время его существования – микросекунды (10-6 сек). Причина таких свойств – в строении. Два атома углерода, связанные тройной связью, находятся в дигональной (линейной) sp-гибридизации. Для таких атомов стандартный угол между s-связями 180о. В бензоле угол между С-С связями 120о. Дегидробензол имеет очень большое угловое напряжение и стремиться присоединить любые частицы, чтобы превратиться в ненапряженное производное бензола.
Амидный анион атакует дегидробензол с образованием анилиниевого аниона, который проявляет столь сильные основные свойства, что по отношению к нему аммиак проявляет свойства кислоты (отдает протон).
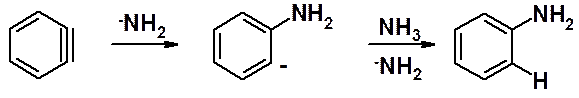
Результат реакции – анилин.
Ариновый механизм доказан несколькими экспериментальными фактами.
Дегидробензол нельзя выделить, но удалось перехватить и идентифицировать продукт превращения.
Если в реакцию взять арен, в котором галоген связан с изотопной меткой, в результате образуется смесь изомеров в почти эквимолярном соотношении.
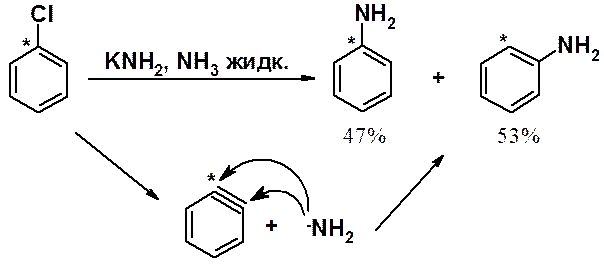
2,6-Димещенные галогенобензолы не вступают в реакцию с амидом калия, потому что невозможна первая стадия превращения – отщепление протона (нет протона).

· Классификация и номенклатура. Характер связи углерод-металл и свойства металлорганических соединений в зависимости от положения металла в периодической системе химических элементов Д.И.Менделеева.
· Магнийорганические соединения, их получение и свойства: взаимодействие с веществами, содержащими активный водород, с галогенопроизводными, карбонильными соединениями, углекислым газом, окисью этилена, нитрилами. Значение металлоорганических соединений в синтетической органической химии. Техника безопасности при работе с металлорганическими соединениями.
Гидроксилпроизводные со связью С(sp3)-OH.
· Одноатомные спирты. Классификация, изомерия, номенклатура. Строение спиртов. Характеристики связей С-О и О-Н, полярность, поляризуемость. Физические свойства. Водородная связь, ее влияние на физические свойства и спектральные характеристики спиртов.
· Методы синтеза: гидратация алкенов, гидролиз галогеналканов, восстановление альдегидов, кетонов и сложных эфиров, взаимодействие магнийорганических соединений с альдегидами, кетонами, окисью этилена, гидроборирование. Промышленные методы получения спиртов.
Металлорганические соединения – органические вещества, в которых атом металла непосредственно связан с атомом углерода.
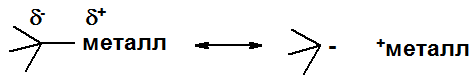
Свойства связи углерод-металл могут быть показаны граничными структурами. Характер связи изменяется от практически ионной (с сильно электроположительными металлами, типа калия) до практически средне полярной ковалентной (Hg). Соединения с сильно ионным характером связи (С-Li, Na, K) проявляют очень высокую реакционную способность, часто взрываясь на воздухе или при контакте с водой. Соединения с сильно ковалентной связью углерод-металл стабильны на воздухе, не реагируют с водой, хорошо растворимы в большинстве органических растворителей и весьма токсичны.
Органические соединения натрия – промежуточные продукты в рассмотренной (раздел «Алканы») ранее реакции Вюрца.
Из этого класса веществ наиболее широко в органическом синтезе применяются магнийорганические соединения – реактивы Гриньяра (Нобелевская премия, 1912 г.).
Реактивы Гриньяра получают действием металлического магния на алкил- или арилгалогениды в абсолютном эфире, приборе, изолированном от контакта с воздухом).
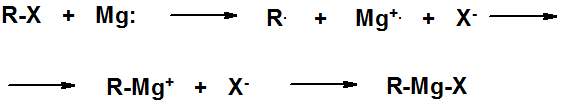
Связь углерод-магний сильно полярная, электронная плотность сдвинута к атому углерода. Реактивы Гриньяра мгновенно реагируют с веществами, содержащими активный водород (способными быть донорами протона) с образованием углеводорода и основного галогенида магния.
![]()
Магнийорганические соединения используют в органической химии для получения соединений самых разных классов.
Так, реакция реактивов Гриньяра с галогеноалканами позволяет получать насыщенные углеводороды. Причем в отличие от реакции Вюрца удается синтезировать и несимметричные производные (реакция Вюрца-Гриньяра):
![]()
Реакции с карбонильными и эпокси-соединениями и приводят к спиртам, с углекислым газом – к кислотам, с солями кадмия – к кетонам и т.д. и т.п.
При планировании синтезов с реактивами Гриньяра следует учитывать их высокую реакционную способность и структурные ограничения, которые она вызывает. Кроме атома галогена, который реагирует с металлическим магнием, в молекуле на должно быть групп, способных выступать в качестве доноров протона. Например, нельзя получить реактив Гриньяра из соединения, содержащиего галоген и гидрокси-группу, которая будет сразу реагировать с образующимся магнийорганическим соединением.
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.