Коэффициент самодиффузии Fe в аустените можно выразить следующим соотношением:
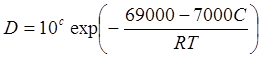 см2/с,
(5.33)
см2/с,
(5.33)
где с - концентрация углерода, ат. %
На рис. 5.8 приведена зависимость коэффициента диффузии от концентрации при диффузии различных металлов в медь. Влияние концентрации становится заметным, когда она превышает 1/4-1/5 концентрации насыщения: вблизи границы растворимости при данной температуре влияние концентрации особенно резко.
Для диффузии углерода в γ-Fe установлена следующая зависимость константы D0, (см2/с). от концентрации углерода С, (мас. %): D0=0,04+0,08 С. Значение Q в этом случае остается (в пределах погрешности измерений) постоянным.
В л и я н и е т р е т ь е г о к о м п о н е н т а. Переход от диффузии в чистых металлах к бинарным системам; как видно, значительно усложняет задачу. Переход же к многокомпонентным системам приводит к еще большим усложнениям.
Рассмотрим это на примере перехода к тройным системам. Было проведено сравнительное изучение плотно соединенных образцов сплавов Fe+O,4% С и Fe+O,4% С +4% Si при температуре 1050°С. При этой температуре сплавы однофазны (аустенит). Так как между сплавами отсутствует градиент концентрации углерода, то по первому закону Фика не должно быть потока углерода. Однако после отжига в течение 13 дней в образце был обнаружен градиент концентрации в области стыка. Таким образом, диффузия С привела к возникновению градиента концентрации. Этот эффект связан с возрастанием химического потенциала С при добавлении к сплаву Si. В результате происходит перераспределение С в области стыка таким образом, чтобы обеспечивалось локальное равновесие. В этой области имелось резкое изменение концентрации Si, поэтому для локального равновесия необходимо столь же резкое изменение концентрации С.
Приведенный при мер показывает, что при анализе диффузии первое уравнение Фика следует использовать в виде
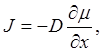 (5.34)
(5.34)
где μ - химический потенциал диффундирующего элемента.
При этом значения D представляют собой эмпирические константы, зависящие от градиента концентрации и от состава сплава.
П р и р о д а д и ф ф у н д и р у ю щ е г о м е т а л л а. Чем сильнее природа диффундирующего элемента отличается от природы растворителя, тем больше значение коэффициента диффузии. Возможно, это связано со степенью искажения силовых полей в близи растворенного атома. В то же время искажение силовых полей снижает предельную растворимость диффундирующего элемента. Подобная зависимость была, например, установлена при диффузии Sn, Si, Al, Zn в меди. Оказалось, что при постоянной температуре коэффициенты диффузии тем больше, чем дальше диффундирующий элемент от меди в периодической системе элементов. Для самодиффузии в металлах характерны малые значения коэффициентов.
Влияние типа твердого раствора. Энергия активации при диффузии элемента, растворяющегося по типу внедрения, меньше, чем при диффузии элемента, растворяющегося по типу замещения в том же растворителе (см. табл. 5.1).
В твердых растворах вычитания диффузия того компонента, часть узлов которого в кристаллической решетке вакантна, осуществляется тем легче, чем больше "пустых мест" в решетке. Это подтверждается данными В. И. Архарова, установившего, что Fe легко диффундирует сквозь вюстит FeO, имеющий значительный дефицит железных ионов, в то время как сквозь окись никеля и кобальта с очень незначительным избытком кислорода металлические ионы диффундируют весьма медленно.
Аналогичный результат получен при исследовании диффузии Со в электронном соединении CoAl, способном растворять Со по типу замещения и Al по типу вычитания.
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.