МИНИСТЕРСТВО ОБРАЗОВАНИЯ И НАУКИ
РОССИЙСКОЙ ФЕДЕРАЦИИ
НОВОСИБИРСКИЙ ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТ
Факультет естественных наук
ПРАКТИКУМ
ПО ФИЗИЧЕСКОЙ ХИМИИ
КОНДУКТОМЕТРИЯ
Методическое пособие
Новосибирск
2008
Методическое пособие содержит описание лабораторных работ, выполняемой в практикуме по химической термодинамике и химической кинетике.
Предназначено для студентов 3-го курса факультета естественных наук Новосибирского государственного университета.
Составители
канд. хим. наук, доц. В. А. Рогов,
канд. хим. наук М. В. Лузгин,
зав.лаб. Н. В. Ложкина
Рецензент
д-р хим. наук Е. П. Талзи
©Новосибирский государственный
университет, 2008
Основные понятия и законы кондуктометрии
Электрическое сопротивление раствора (R) – величина, определяемая законом Ома:
![]() ,
,
где I – ток, протекающий через раствор, U – разность потенциалов между электродами. Корректное измерение величины R требует специальных приёмов, которые мы обсудим ниже. Единицей измерения электрического сопротивления является [Ом].
Электропроводность раствора – величина, обратная его сопротивлению. Её размерностью является [Ом–1], или, что то же, сименс [См].
Удельная электропроводность ![]() – это электропроводность
слоя раствора длиной 1 см, заключенного между электродами площадью 1 см2
при условии, что отсутствуют краевые эффекты. Она выражается в Ом–1×см–1
или См×см–1.
Шкала используемого в работе кондуктометра градуирована в мСм×см–1. В системе СИ удельная электропроводность измеряется в Ом–1×м–1,
или См×м–1.
– это электропроводность
слоя раствора длиной 1 см, заключенного между электродами площадью 1 см2
при условии, что отсутствуют краевые эффекты. Она выражается в Ом–1×см–1
или См×см–1.
Шкала используемого в работе кондуктометра градуирована в мСм×см–1. В системе СИ удельная электропроводность измеряется в Ом–1×м–1,
или См×м–1.
Эквивалентная электропроводность (l) равна электропроводности объёма раствора, заключенного между двумя параллельными электродами, отстоящими друг от друга на 1 см и имеющими такую площадь, что в этом объёме раствора содержится 1 г-экв растворенного вещества при условии, что отсутствуют краевые эффекты. В системе СИ эквивалентная электропроводность выражается в См×м2×г-экв–1 или, для 1-1 валентного электролита, в См×м2×моль–1
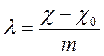 ,
,
где
![]() – удельная электропроводность чистого
растворителя, а m – эквивалентная концентрация (нормальность) раствора.
– удельная электропроводность чистого
растворителя, а m – эквивалентная концентрация (нормальность) раствора.
При использовании этих и последующих формул следует аккуратно относиться к выбору размерностей величин. Как уже видно, в размерностях фигурируют Ом (система СИ), cм (СГС) и моль/л (внесистемная единица). Приводимые в некоторых учебниках численные коэффициенты без указания их размерностей увеличивают вероятность ошибки. В справочниках всё, конечно, правильно, но нужно внимательно читать подписи к таблицам. Целесообразно придерживаться системы СИ, при этом эквивалентная электропроводность должна браться в Ом–1×м2×г-экв–1. Концентрацию растворов следовало бы измерять в моль/м3. Тем не менее, в соответствии со сложившейся традицией концентрация обычно бывает выражена в моль/л. В дальнейшем в необходимых местах сделаны соответствующие оговорки.
Эквивалентную электропроводность можно представить в виде суммы ионных электропроводностей li. Для 1,1–валентного электролита
![]() ,
,
где l+и l – относятся к катиону и аниону.
Эквивалентная электропроводность растворов электролитов возрастает с ростом разбавления раствора и при бесконечном разбавлении (т. е. при бесконечно малой концентрации) достигает предельного значения, которое называется эквивалентной электропроводностью раствора при бесконечном разведении (l0).
В разбавленных растворах сильных электролитов выполняется эмпирический закон Кольрауша (закон квадратного корня):
![]() ,
,
где l и l0 – эквивалентная электропроводность раствора с эквивалентной концентрацией m и при бесконечном разведении, A – константа, зависящая от заряда иона, но не от его природы.
Теория Дебая–Хюккеля–Онзагера, учитывающая межионные взаимодействия, даёт для 1,1-валентного сильного электролита следующее уравнение для связи l и l0:
![]() или
или ![]() ,
(1)
,
(1)
где
![]() – предельное значение
– предельное значение ![]() , С – концентрация. Коэффициенты b1 и b2, зависящие от
диэлектрической проницаемости растворителя и температуры, рассчитываются по
формулам
, С – концентрация. Коэффициенты b1 и b2, зависящие от
диэлектрической проницаемости растворителя и температуры, рассчитываются по
формулам
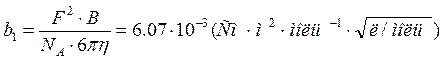 ; (2)
; (2)
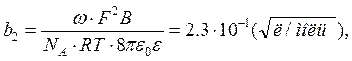 (3)
(3)
где В
![]() (4)
(4)
В формулах (1)–(4) w – числовой коэффициент, который для симметричного электролита равен 0.1953; F – число Фарадея; В – параметр; h – вязкость, остальные обозначения общепринятые. Численные значения b1, b2 и В рассчитаны для воды при 250 С, используется система СИ, но концентрация выражена в моль / л. Поэтому ниже во всех выражениях, где используются формулы (1)–(4) концентрация также должна быть взята в моль/л.
В справочной литературе зависимость λ от концентрации для водных растворов сильных электролитов обычно представлена в виде
![]() ,
,
где
коэффициенты λ*, ![]() и
и ![]() применимы в области концентраций 0.001–0.1
моль/л. Коэффициент λ* практически совпадает с l0.
применимы в области концентраций 0.001–0.1
моль/л. Коэффициент λ* практически совпадает с l0.
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.