Порядок работы на кондуктометре. После включения прибора нужно погрузить датчик в исследуемый раствор, дождаться стабилизации температуры и установления показаний, прочесть их или записать в «блокнот». Внутренняя полость датчика, где закреплены электроды, должна быть полностью заполнена раствором. Результат измерения индицируется на жидкокристаллическом экране, выводится одна из двух величин: удельная электропроводность раствора или его «минерализация», т. е. концентрация электролита. При выполнении измерений компьютер, связанный с прибором, может быть включен, но не следует открывать программу связи «Dcom.exe», т. к. её запуск создает помехи работе кондуктометра.
Устройство кондуктометрической ячейки, используемой при работе с мостом переменного тока, показано на рис. 5. Ячейка состоит из сосуда (1), в который герметично впаяны платиновые электроды (2). С помощью платиновой проволоки (3) электрод соединяется с медной проволокой (4). Точка (5) – место спая платины с медью. Часто платиновые электроды в ячейках платинируют, т. е. покрывают гладкую поверхность электродов платиновой чернью путём электролиза в растворе платинохлористоводородной кислоты.
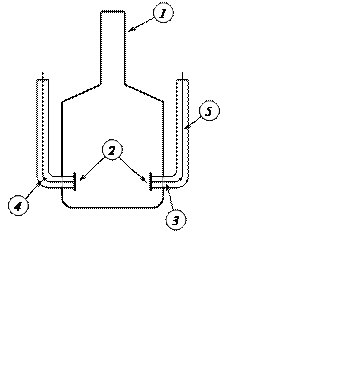
Рис. 5. Кондуктометрическая ячейка
Кондуктометр «Анион» рассчитан на применение только с датчиком, который входит в комплект данного прибора, и не является взаимозаменяемым элементом. Датчик имеет пластиковый корпус цилиндрической формы, в котором сделана сквозная прорезь, внутри неё размещены электроды (см. рис. 4). Его помещают в исследуемый раствор, залитый в стеклянный стаканчик, или ввинчивают в корпус проточной ячейки.
Задача К-1
КОНДУКТОМЕТРИЧЕСКОЕ ТИТРОВАНИЕ
Титрование обычно проводят с цветными индикаторами, но иногда более удобными являются инструментальные методы. Конечную точку титрования можно определить, например, потенциометрически или кондуктометрически. Кондуктометрическое титрование может использоваться при определении концентрации электролита в случае окрашенных или мутных растворов и при титровании смесей кислот или оснований, когда подбор цветного индикатора затруднён.
Рассмотрим титрование сильной кислоты щелочью
![]() .
.
Будем
считать, что концентрация титрующего раствора достаточно велика, чтобы можно
было пренебречь изменением объёма исследуемого раствора. Предполагая, что
подвижность ионов не зависит от концентрации, выразим удельную
электропроводность ![]() через концентрации ионов и их
ионные электропроводности. Пусть
через концентрации ионов и их
ионные электропроводности. Пусть ![]() – исходная концентрация
кислоты,
– исходная концентрация
кислоты, ![]() – число молей прилитой щелочи отнесенное к
объёму исследуемого раствора.
– число молей прилитой щелочи отнесенное к
объёму исследуемого раствора.
Для кислой области (y < a) получаем уравнение
|
|
(7) |
Для щелочной области (y > a) получаем другое уравнение:
|
|
(8) |
В точке эквивалентности
![]() (9)
(9)
Поскольку ![]()
![]() то,
как видно из уравнений (7) и (8), в кислой области удельная электропроводность
уменьшается при добавлении щелочи, а в щелочной – увеличивается. Таким образом,
зависимость
то,
как видно из уравнений (7) и (8), в кислой области удельная электропроводность
уменьшается при добавлении щелочи, а в щелочной – увеличивается. Таким образом,
зависимость ![]() от
от ![]() представляет
собой два отрезка прямых, пересекающихся в точке эквивалентности (рис. 6).
представляет
собой два отрезка прямых, пересекающихся в точке эквивалентности (рис. 6).


Рис. 6. Изменение удельной электропроводности раствора кислоты в зависимости от количества прилитой щелочи
Цель настоящей работы состоит в том, чтобы определить концентрацию раствора HCl титрованием с KOH. Затем по полученным данным оценить:
– ионные электропроводности ![]() и
и
![]() ;
;
– эквивалентные электропроводности ![]() и
и ![]() ;
;
– подвижности ионов ![]() и
и ![]() ;
;
– числа переноса ионов ![]() и
и ![]() в растворах HCl и KOH;
в растворах HCl и KOH;
– радиусы ионов ![]() и
и ![]() .
.
Проведение измерений
Для измерения удельной электропроводности используют кондуктометр «Анион-4120».
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.