В термостатируемый стаканчик наливают 40 мл раствора HCl с концентрацией 0.01 М, опускают датчик и измеряют удельную электропроводность. Затем титруют 0.2 н раствором KOH с помощью микробюретки, измеряя электропроводность раствора через интервалы примерно 0.1–0.2 мл. Записывают в таблицу объём добавленной щелочи и значения удельной электропроводности.
Строят график зависимости удельной электропроводности титруемого раствора от объёма добавленной щелочи. Находят точку излома и определяют начальную концентрацию кислоты по данным кондуктометрического титрования, считая, что концентрация щелочи известно точно.
Определяют по графику удельную электропроводность c в точке излома и угловые коэффициенты прямых в кислой и щелочной областях.
Поскольку в точке эквивалентности единственным
электролитом в растворе является KCl с концентрацией 0.01 М, то ожидаемое значение ![]() равно 0.001411 ом–1см–1
при 25 0 С.
равно 0.001411 ом–1см–1
при 25 0 С.
По значениям угловых коэффициентов, используя
уравнения (7)–(9), оценивают ионные электропроводности ![]() ,
,
![]() ,
, ![]() и
и ![]() , принимая, что
, принимая, что ![]() .
.
Оценивают подвижности и числа переноса ионов H+ и OH– в растворах HCl и KOH.
Оценивают по формуле Стокса радиусы сольватированных ионов K+ и Cl–.
Задача К-1
КОНДУКТОМЕТРИЧЕСКОЕ ТИТРОВАНИЕ
(дополнение)
Задача К-1 может выполняться в нескольких вариантах.
Во всех случаях будем полагать, что: 1) для титрования используется раствор
сильной щелочи КОН; 2) концентрация титрующего раствора достаточно
велика, чтобы можно было пренебречь изменением объёма исследуемого раствора или
учесть это изменение, как поправку; 3) подвижность ионов не зависит от концентрации.
Будем использовать обозначения: ![]() º
º ![]() – исход-ная концентрация
кислоты,
– исход-ная концентрация
кислоты, ![]() – число молей прилитой щелочи отнесенное к
объёму исследуемого раствора.
– число молей прилитой щелочи отнесенное к
объёму исследуемого раствора.
Вариант № 1. Титрование сильной кислоты. Этот вариант рассмотрен в основной части методического пособия «Кондуктометрия».
Вариант № 2. Титрование слабой кислоты. Можно использовать, например, уксусную кислоту.
![]() .
.
В этом случае кривая титрования имеет иной вид, нежели в предыдущем варианте. Для того чтобы понять причины этого различия введём упрощающие допущения.
Предположим, что соль KA полностью диссоциирована, а степень диссоциации кислоты a невелика, но все же достаточна, чтобы пренебречь диссоциацией воды. При этом в «кислой» области (y < a) уже при небольших добавках КОН к титруемой кислоте оказывается, что концентрации ионов A– и K+ примерно одинаковы и равны величине у. Концентрация протонов может быть найдена из выражения для константы равновесия
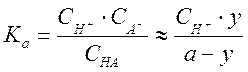
Для качественного анализа ситуации предположим,
что ![]() , то есть рассмотрим вид кривой титрования
в начальной области, где, как оказывается, концентрация
, то есть рассмотрим вид кривой титрования
в начальной области, где, как оказывается, концентрация ![]() изменяется
приблизительно обратно пропорционально величине
изменяется
приблизительно обратно пропорционально величине ![]() .
.
![]()
В «кислой» области удельная электропроводность ![]() связана с концентрациями ионов и их
ионными электропроводностям как
связана с концентрациями ионов и их
ионными электропроводностям как
![]()
При увеличении величины у,первое слагаемое уменьшается, а второе линейно возрастает. Суммарный эффект может быть различным, в частности, удельная электропроводность раствора при увеличении у может проходить через минимум.
Для «щелочной» области (y > a) получаем другое уравнение:
![]()
![]()
В точке эквивалентности в растворе присутствует только ацетат калия и
![]()
Видно, что в «щелочной» области удельная электропроводность увеличивается при увеличении у, то есть при добавлении КОН.
Таким образом, зависимость ![]() от
от ![]() в
«кислой» и «щелочной» областях описывается разными выражениями. В точке
эквивалентности на зависимости
в
«кислой» и «щелочной» областях описывается разными выражениями. В точке
эквивалентности на зависимости ![]() от
от ![]() должен наблюдаться излом, а на зависимости
должен наблюдаться излом, а на зависимости ![]() от
от ![]() должен
наблюдаться скачёк.
должен
наблюдаться скачёк.
Цель работы в варианте №2 состоит в том, чтобы определить концентрацию раствора слабой кислоты титрованием с КОН. Кроме этого по полученным результатам можно:
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.