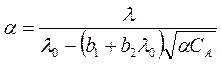 .
.
Для его решения можно воспользоваться методом итераций, в качестве первого приближения принять, что
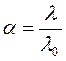 ,
,
Это приближение состоит в том, что единственной причиной отличия l от l0 полагается неполная диссоциация электролита.
Для последующих приближений следует пользоваться выражением
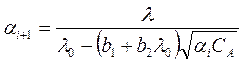 .
.
Обычно достаточно вычислить a во втором приближении.
Проведение измерений и обработка результатов
Для измерения удельной электропроводности используют кондуктометр «Анион-4120».
В мерных колбах на 100 мл готовят рабочие растворы уксусной кислоты в дистиллированной воде. Всего готовят 10 растворов с концентрациями от 0.3 до 0.005 моль / л. Концентрации растворов уточняют титрованием раствором KOH. Растворы термостатируют при 25 0 С. Заливают растворы в измерительную ячейку, которая также термостатируется при 25 0 С, измеренные значения удельной электропроводности заносят в таблицу (см. с. 19), рассчитывают степень диссоциации кислоты.
|
Номер опыта |
Конц. кислоты, СА моль/л |
Удельн. электропроводн-ость, c См× см–1 |
Эквивалентная электропроводность, l См×см2×моль–1 |
Степень дис-социации, (первое приближние), a1 = l / l0 |
Степень ди-ссоциации, (второе при-ближение), a2 |
Для определения константы диссоциации заполняют таблицу.
|
Номер опыта |
СА моль / л |
a2 |
|
|
|
lgKa |
Ka |
КОНТРОЛЬНЫЕ ВОПРОСЫ К ЗАДАЧАМ К-1 и К-2
1. Назовите единицы измерения следующих величин: сопротивление, удельная электропроводность, эквивалентная электропроводность, подвижность иона, число переноса.
2. Как учитывается форма сосуда, в котором проводятся кондуктометрические измерения?
3. Когда для измерения электропроводности используют мост постоянного тока, а когда переменного? Способы снижения поляризации электродов.
4. Предельные законы кондуктометрии.
5. Теория Дебая–Хюккеля. Какую величину она позволяет рассчитать? Какая модель используется при построении теории? Электрофоретический и релаксационный эффекты.
6. Объясните, почему эквивалентная электропроводность раствора слабой кислоты резко возрастает при уменьшении её концентрации.
Задача К-3
ОПРЕДЕЛЕНИЕ КОНСТАНТЫ СКОРОСТИ РЕАКЦИИ СОЛЬВОЛИЗА трет-БУТИЛХЛОРИДА
Реакции замещения при насыщенном атоме углерода в алифатическом ряду изучены весьма полно благодаря фундаментальным работам школы Ингольда. Предметом исследования были реакции обмена галоида в галоидалкилах на другую частицу. Однако обнаруженные закономерности оказались достаточно общими и в дальнейшем широко использовались для объяснения кинетики многих других реакций.
В общем случае замещение частицы Х в молекуле RX агентом Y может происходить тремя способами в зависимости от природы Y, определяющей способ поставки электронов для образования новой связи R–Y:
SN Y: + R : X ¾® Y : R + X:
SR Y· + R : X ¾® Y : R + X·
SE Y + R : X ¾® Y : R + X
Если новая связь образуется за счет неподеленной пары электронов атакующего агента, то реакция называется нуклеофильным замещением и обозначается SN, а агенты Y: – нуклеофильными агентами. Примерами таких агентов могут служить OH–, Н2О, NH3 и др., а примером реакции нуклеофильного замещения – гидролиз (СН3)3СCl:
H–O–H + R–Cl ¾® H+ + H–O–R + Cl–.
При радикальном замещении (SR) новая связь образуется за счет одного неспаренного электрона Y· и одного из электронов разрываемой связи.
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.