11.2. Дополнительная литература.
12. Глоссарий.
13. Содержание.
1. Гомологический ряд предельных углеводородов.
Синонимы: насыщенные, метановые углеводороды, парафины, углеводороды ряда метана.
 |
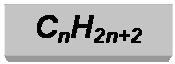 Это большая группа веществ – углеводородов, отвечающих
общей формуле
Это большая группа веществ – углеводородов, отвечающих
общей формуле
где n любое целое число, не равное 0.
Гомологический ряд алканов изучен немецким химиком Карлом Шорлеммером. В изучение конкретных представителей алканов внесли свою лепту целый ряд учёных – химиков.
Ряд начинается с простейшего алкана – метана СН4. Познакомиться с важнейшими представителями алканов Вы можете в таблице 2. Все углеводороды отличаются друг от друга на определённое количество гомологических разностей «СН2». Гомологический ряд алканов, как и других веществ условно бесконечен. На сегодняшний день известны соединения, содержащие очень большое количество атомов углерода.
Предельные углеводороды, как и все члены одного гомологического ряда, обладают схожими элементами строения, принципами номенклатуры и химическими свойствами. Их низкая химическая активность, обусловленная особым строением, обусловило одно из названий класса – «парафины», что символизирует их инертность.
Алканы широко распространены в природе и имеют важное промышленное значение.
2. Строение алканов:
Предельные углеводороды, являясь насыщенными, содержат в своём составе атомы углерода, находящиеся в 1 валентном состоянии sp3 гибридизации. При таком типе гибридизации, гибридные облака располагаются в пространстве в форме тетраэдра. (Рис. 1). Валентный угол (расстояние между осями, на которых лежат электронные облака), составляет 109 градусов 28 минут.
 Так как в атоме углерода отсутствуют неподеленные
Так как в атоме углерода отсутствуют неподеленные
|
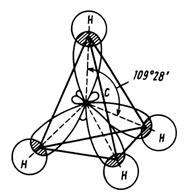 Атом
углерода соединён только одной химической σ-связью с соседним атомом. То есть,
связи в молекулах алканов ординарные. Молекула метана – простейшего алкана имеет также
тетраэдрическое строение (рис. 2).
Атом
углерода соединён только одной химической σ-связью с соседним атомом. То есть,
связи в молекулах алканов ординарные. Молекула метана – простейшего алкана имеет также
тетраэдрическое строение (рис. 2).
|
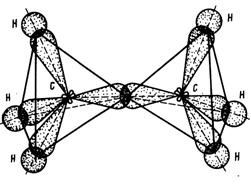
Если рассматривать углеводороды с более длинной цепью углеродных атомов, то можно заметить, что молекулы алканов в пространстве имеют зигзагообразную форму (рис 4).
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.