4)
Даны следующие вещества:
пентан, 2,2-диметилпропан, 2,метилбутан, 2,2-диметилбутан. Выберете из них
изомеры и гомологи. Выбор обоснуйте.
5) Назовите вещество по систематической и рациональной номенклатуре:
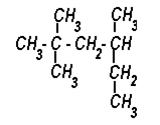 |
6) Назовите вещество по систематической номенклатуре.
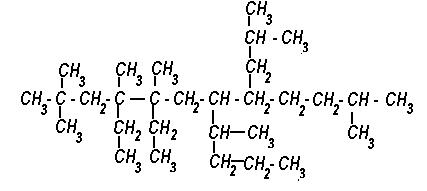
7) Получите пропан 5-ю способами. Укажите условия данных реакций.
8) Получите только из одного органического вещества 2,2,3,3,-триметилбутан.
9) Предложите промышленные способы получения бутана.
10) Напишите уравнения реакций между следующими веществами:
а) йодистым бутилом и металлическим натрием.
б) смесью йодистого этила, бромистого бутила с металлическим калием
в) гидроксидом натрия, и пропионата натрия .
г)2-метилпропана с разбавленной азотной кислотой.
д) пентадекана с концентрированной серной кислотой.
е) крекинга нонана.
11) Напишите уравнения реакций, получения гексана гидрированием различных соединений.
12) Напишите уравнения реакций сульфирования и сульфоокисления гептана.
13) Изобразите электронную формулу 2,2-диметилбутана. Укажите сигма связь, обозначьте и напишите значение валентного угла, длин связей.
14) Восстановите следующие галогенпроизводные: бромистый пропил и изопропил. Напишите уравнения реакций.
15) Напишите уравнение реакции изомеризации бутана. Укажите условия реакции.
16) Напишите уравнение реакции окисления этана в избытке и недостатке кислорода Чем отличаются эти процессы?
17) Пользуясь реакцией Кори-Хауса, получите изопентан.
18) Напишите уравнения окисления высших углеводородов (на примере гептадекана) при помощи хромовой смеси.
9.4. Расчётные задачи
1) Углеводород сожгли. Продуктом сгорания его оказался углекислый газ объёмом 672 л и вода массой 720 г. Найдите формулу этого углеводорода, если он тяжелее воздуха в 1,517 раз.
РЕШЕНИЕ
Найдём количества веществ (моль) – продуктов горения углеводорода.
n(CO2) = (336/22,4)моль
n(CO2) =15 моль.
n(H2O) = (360/18)моль =20 моль.
Выразим количество (моль) атомов элементов углерода и водорода, образующего углеводород.
n(CO2) = n(C) = 15 моль
n(H2O) = 2n(H) = 40 моль.
Cоставим молярные соотношения элементов в веществе.
n(C) : n(H) = 40 : 15 = 8:3
Получаем простейшую формулу C3Н8 Мпрост.=44г/моль
Проверим истинность её, используя условие задачи. Найдём истинную молярную массу этого вещества:
М ист.= 29г/моль*1,517
М ист.=44г/моль.
Истинная формула совпадает с простейшей, значит, истинная формула вещества - C3Н8
ОТВЕТ: C3Н8 - пропан
2) . Какой алкан при горении на воздухе будет образовывать больше копоти – бутан или гексан. Ответ подтвердите расчётом.
РЕШЕНИЕ
Копоть – это неуспевающий сгорать углерод. Найдём массовую долю его в обоих веществах и сравним, из расчёта, что имеем по 1 молю каждого углеводорода.
W(C) (C4Н10) = (12*4)г/58г = 0.828 = 82,8%
W(C) (C6Н14) = (12*6)г/86г = 0.837 = 83,7%
Исходя из расчётов, видим, что гексан содержит большее количество углерода по массе, значит, при горении на воздухе он будет давать больше копоти.
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.