Идеальный газ описывается уравнением Менделеева – Клапейрона:
pV=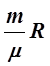 T,
(1)
T,
(1)
где p – давление газа (измеряется в паскалях); V – объём газа (измеряется в кубических метрах); m– его масса (в килограммах); m - масса одного моля газа (в килограммах на моль); T – термодинамическая температура (в кельвинах), R =8,31 кг×моль-1×К-1 – универсальная газовая постоянная.
2. Первое начало (закон) термодинамики утверждает, что количество теплоты dQ, сообщенное системе, расходуется на изменение её внутренней энергии dU и на работу dА, совершаемую системой против внешних сил:
dQ=dU+dA . (2)
Для идеального газа
|
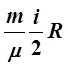 dT,
(3)
dT,
(3)
Здесь i – число степеней свободы – число независимых параметров, определяющих положение и ориентацию молекулы в пространстве.
Работа газа связана с изменением dV его объёма:
dA = p dV . (4)
В частности, если давление газа не меняется (такой процесс называется изобарным), то, с учётом уравнения (1), можно получить:
dA=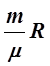 dT. (5)
dT. (5)
Очевидно также, что при V=constdV= 0 и dA= 0.
3. Запишем формулы первого начала термодинамики для основных изопроцессов, которые можно осуществить с идеальным газом.
– Изобарный ( р =const ):
dQ=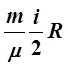 dT+
dT+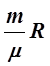 dT, или
dT, или
dQ=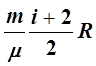 dT.
(6)
dT.
(6)
– Изохорный ( V=const ):
dQ=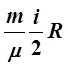 dT.
(7)
dT.
(7)
– Изотермический ( Т =const ):
dQ=pdV. (8)
– Адиабатный (происходящий без теплообмена с окружающей средой, dQ= 0):
0
=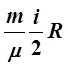 dT + p dV.
(9)
dT + p dV.
(9)
4. Теплоемкостью газаназывается величина равная количеству теплоты, необходимой для нагревания данной массы газа на один кельвин.
с= lim DQ / DT = dQ / dT . (10)
DT®0
|
С = с × 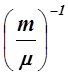 .
.
Получим выражения для теплоёмкости газа в изохорном (при постоянном объёме) Cv и изобарном (при постоянном давлении) Cp процессах.
– При V =const
Cv=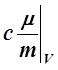 =
=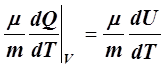 =
=![]() . (11)
. (11)
– При р =const
Cp=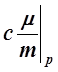 =
=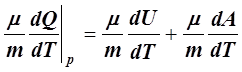 =
=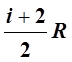 . (12)
. (12)
Из (11) и (12) следует, что
Cp= Cv + R. (13)
Соотношение (13) носит название уравнения Майера.
5. Пользуясь уравнением Менделеева – Клапейрона (1), формулами (11) и (12) для Cv и Cp и соотношением (9) – первым началом термодинамики в случае адиабатного процесса, можно получить формулу, связывающую параметры идеального газа при адиабатном процессе. Для этого достаточно продифференцировать обе части уравнения (1) по Т :
p![]() +V
+V![]() =
=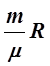 ,
,
откуда
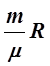 dT = pdV + Vdp,
dT = pdV + Vdp,
и подставить последнее соотношение в формулу (10). Тогда получится:
0 =![]() ( pdV + Vdp)+ p dV,
( pdV + Vdp)+ p dV,
или
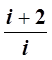 pdV+Vdp= 0.
pdV+Vdp= 0.
|
d 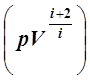 = 0, или
= 0, или
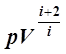 =const. (14)
=const. (14)
С учётом того, что
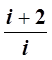 =
=![]() ,
,
формулу (14) можно записать в виде
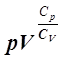 =const. (15)
=const. (15)
Данная формула носит название уравнения Пуассона для адиабатного процесса.
Обозначив отношение Cp/ Cv символом g, уравнение (15) можно переписать:
 pVg =const.
(16)
pVg =const.
(16)
В настоящей работе предлагается найти показатель степени в уравнении Пуассона для сухого воздуха, который при комнатных условиях с хорошей точностью можно считать идеальным газом.
Методика измерений и описание установки
Для определения отношения Сp/ Cv воздуха в данной лабораторной работе применен метод, предложенный Клеманом и Дезормом, в котором использовано охлаждение газа при его адиабатическом расширении.
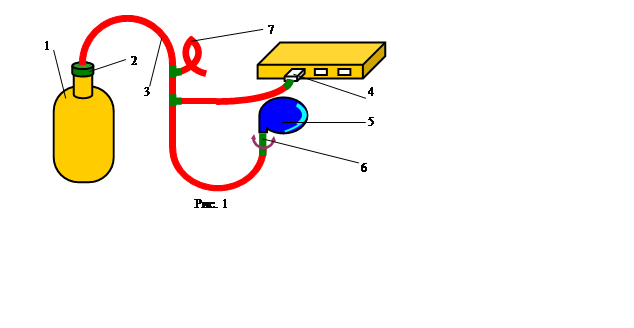
Лабораторный стенд состоит из насоса и баллона, наполненного воздухом и соединенного с манометром (рис. 1).
Посредством крана баллон может сообщаться с атмосферой. В начале эксперимента давление воздуха в баллоне равно атмосферному, а его температура ТОКР равна температуре окружающей среды.
|
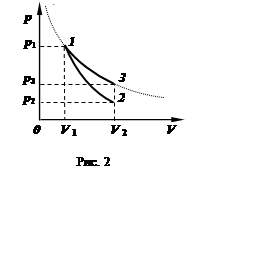
Открыв кран, с помощью насоса можно подкачать в баллон некоторое количество воздуха, в результате чего давление в баллоне повысится до некоторого значения p1. После подкачки следует подождать примерно минуту: за это время в результате теплообмена через стенки температура воздуха внутри баллона опять сравняется с температурой наружного воздуха. Рассматриваемая нами порция газа массой m займёт объём V1, то есть будет сжата остальной частью воздуха. Этому состоянию данной части газа соответствует точка 1 на рис. 2.
После того как давление газа в баллоне установилось, быстро выпускаем часть газа из сосуда, после чего сосуд закрываем. Давление в сосуде (и в выделенной порции газа) упадёт до р2.
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.