Продувочные и “танковые” газы из системы синтеза и охлаждения аммиака сжигаются в смеси с топливным газом в горелках печи первичного риформинга. Смешение газов производится после подогрева топливного газа в конвекционной камере до не более 150 °С, так как температура смеси не должна быть менее 40 °С, во избежание образования карбонатов аммония.
Объемная доля продувочных и “танковых” газов в смеси не более 15 %.
3.3. Расчеты технологических процессов.
3.3.1 Расчет материальных балансов.
В данном разделе ведется расчет технологических параметров синтеза аммиака, а в частности материальных балансов.
Принципиальная, упрощенная технологическая схема получения аммиака.
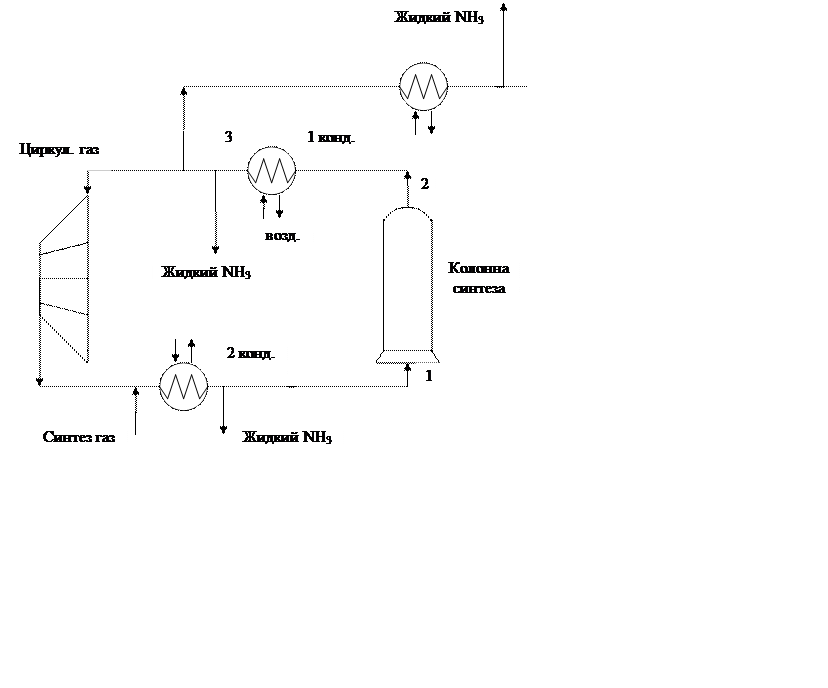
Рис. 3.1.
Содержание аммиака в газе, поступающем в колонну синтеза, определяется условиями вторичной конденсации. При температуре вторичной конденсации –5 °С и давлении 25 МПа (условия берем из регламента цеха производства аммиака завода «Череповецкий Азот») концентрация аммиака определится средней по результатам из формул
- Ларсона и Блека [7]:
lg NNH3 = 4.1856 + 5.98788/![]() P – 1099,544/(273 + tконд)
P – 1099,544/(273 + tконд)
lg NNH3 = 4.1856 + 5.98788/![]() 250 – 1099.544/(273-23)
250 – 1099.544/(273-23)
NNH3 = 3.4 об.%
- Михельса:
lg NNH3 = 2,35916 + 6,56799 /![]() 10,2*P – 1168.1288/(273+t)
10,2*P – 1168.1288/(273+t)
NNH3 = 2.6 об.%
lg NNH3 = 2.423025 + 5.28048 /![]() 10,2*P – 1127.9013 / (273+t)
10,2*P – 1127.9013 / (273+t)
NNH3 = 5.1 об.%
lg NNH3 = 2.5814 + 3.39444 /![]() 10,2*P – 1094.7342 /
(273+t)
10,2*P – 1094.7342 /
(273+t)
NNH3 = 4.06 об.%
Найдем среднюю: NNH3 ср.= (3,4+2,6+5,1+4,06)/4
Отсюда NNH3 = 3,8 об.%.
Расчет равновесного состава газа.
Состав газа поступающего в колонну:
NH3 – 3,8 %
H2 – 61,95 %
N2 – 20,65 %
CH4 – 9,7 %
Ar – 3,9 %
Давление в колонне 25 атмосфер, температура 500оС.
Расчет равновесного содержание аммиака:
Kp = Pa / (PH23/2 * PN21/2)
Kp = (0.038 – X*)*(1-X*) / ((0.6195 – (3/2)*X*)3/2 * (0.2065-(1/2)*X*)1/2 * P)
Kp = (2074.8/T – 2.494*lg(T) – 1.256*10-4 * T + 1.856*10-7 + 3.214)
Kp = 0.05114 МПа-1
X*=0,1221 моль NH3/моль
Степень приближения к равновесию ζ=0,9
Рассчитаем Xраб.
Xраб= ζ * X*
Xраб=0,9*0.1221=0.11 моль NH3/моль
Концентрация аммиака на выходе с колонны:
Nа = (0,038+0,11)/(1-0,11) = 0,1662 м.д. или 16,62 об%.
Материальный баланс считаем на 1000 нм3 газовой смеси.
1000 нм3 циркуляционного газа это 44,643 моля.
Количество образовавшегося аммиака в колонне:
ΔnNH3=44,643*0.11=4.91 кмоль NH3/т.нм3 циркуляционного газа.
Рассчитаем материальный баланс колонны:
Расчет равновесного состава газа на входе в колонну синтеза:
Зная состав циркуляционного газа на входе сосчитаем содержание компонентов смеси.
NNH3 = 44.643*0.038 = 1.696 кмоль
NH2 = 44.643*0.6195 = 27.656 кмоль
NN2 = 44.643*0.2065 = 9.218 кмоль
NAr = 44.643*0.039 = 1.741 кмоль
NCH4 = 44.643*0.097 = 4.331 кмоль
Расчет газа на выходе из колонны синтеза:
Зная, что в колонне образовалось 4.91 кмоль аммиака, общее количество газовой смеси уменьшится.
44,643 – 4,91 = 39,467 кмоль
NNH3 = 1.696 + 4.91 = 6.87 кмоль
Инертные газы остаются в том же количестве.
NAr = 44.643*0.039 = 1.741 кмоль
NCH4 = 44.643*0.097 = 4.331 кмоль
Соотношение N2 / H2 = 1/3. Количество азота и водорода в системе:
NH2 = 27,656 – 4,91*3/2 = 19,895 кмоль
NN2 = 9.218 – 4,91*1/2 = 6,631 кмоль
Полученные данные заносим в таблицу №. 3.1.
Таблица 3.1.
Сводная таблица материального баланса колонны синтеза аммиака
|
Приход |
Расход |
||||||
|
Статьи прихода |
кмоль |
кг |
об% |
Статьи расхода |
кмоль |
кг |
об% |
|
Цирк.газ NH3 H2 N2 Ar CH4 |
44,643 1.696 27.656 9.218 1.741 4.331 |
28.832 55.312 258.104 69.64 69.296 |
100 3.8 61.95 20.65 3.9 9.7 |
Цирк.газ NH3 H2 N2 Ar CH4 |
39.467 6.87 19.895 6.631 1.741 4.331 |
116.79 39.79 185.668 69.64 69.296 |
100 17.41 50.41 16.8 4.41 10.97 |
|
Итого: |
481.184 |
Итого: |
481.184 |
||||
Рассчитаем количество аммиака сконденсировавшегося на первой конденсации.
Температура конденсации -5оС.
Давление 25 МПа = 250 атмосфер.
При температуре первичной конденсации -5 °С и давлении 25 атм (условия берем из регламента цеха производства аммиака завода «Череповецкий Азот») концентрация аммиака определится по формуле Ларсона и Блека [7]:
lg NNH3 = 4.1856 + 5.98788/![]() P – 1099,544/(273 + tконд)
P – 1099,544/(273 + tконд)
lg NNH3 = 4.1856 + 5.98788/![]() 250 – 1099.544/(273-5)
250 – 1099.544/(273-5)
Отсюда NNH3 = 6,48 об.%.
Количество сконденсировавшегося аммиака рассчитаем по уравнению:
NNH3 = (nам(2) – Δnж)/(∑ni – Δnж),
где nам(2) – количество аммиака после колонны синтеза;
∑ni – сумма количеств веществ смеси после колонны;
Δnж – количество сконденсировавшегося аммиака при первой конденсации.
0,0648 = (6,87 – Δnж)/(39,467 – Δnж)
Δnж = 4,61кмоль.
Количество газовой фазы уменьшится на количество сконденсировавшегося аммиака и станет: 6.87 – 4.61 = 2.26 кмоль.
Составим материальный баланс первой конденсации.
Таблица 3.2.
Сводная таблица материального баланса первой конденсации.
|
Приход |
Расход |
||||||
|
Статьи прихода |
кмоль |
кг |
об% |
Статьи расхода |
кмоль |
кг |
об% |
|
Цирк.газ NH3 H2 N2 Ar CH4 |
39.467 6.87 19.895 6.631 1.741 4.331 |
116.79 39.79 185.668 69.64 69.296 |
100 17.41 50.41 16.8 4.41 10.97 |
Цирк.газ NH3 H2 N2 Ar CH4 |
34.857 2.26 19,895 6,631 1.741 4.331 Жидк.фаза 4.61 |
38,42 39,79 185,668 69,64 69,296 78,37 |
100 6,484 57,076 19,023 4,995 12,422 |
|
Итого: |
481.184 |
Итого: |
481,184 |
||||
Рассчитаем количество продувочных газов, синтез-газа и количество аммиака, сконденсировавшегося на второй конденсации.
Введем неизвестные:
X1 – продувочные газы, кмоль.
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.