












Лекция 2 по титриметрии
РАСЧЕТ РЕЗУЛЬТАТОВ АНАЛИЗА ПО ТИТРУ
СТАНДАРТНОГО РАСТВОРА
При известном значении титра стандартного раствора формулы (7)–(10) принимают вид:
ЭA . TB . VB
m¢A = _______________ ; (11)
ЭВ
ЭA . TB . VB 100 %
ω A = _______________ . _________ ; (12)
ЭB a
ЭA . TB . VB VK
mA = _______________ . _____ ; (13)
ЭB VA
ЭA . TB . VB VK 100 %
ω A = ________________ . _____ . ________ . (14)
ЭB VA a
Если вычисления производят с использованием титра по определяемому веществу, тогда формулы (11) – (14) преобразуются следующим образом:
m¢A = TB/A . VB ; (15)
100 %
ω A = T B / A . VB . ________ ; (16)
a
VK
m A = T B / A .VB _______ ; (17)
VA
VK 100 %
ω A = TB/A . VB _______ ________ . (18)
VA a
Пример 13. Азотная кислота неизвестной концентрации разбавлена водой и доведена до метки в мерной колбе вместимостью 250 см3. На титрование 25 см3 полученного раствора израсходовано 32 см3 раствора едкого натра с Т = 0,063 00 г/см3. Вычислить содержание HNO3 (г).
Решение. Используя формулу (13), запишем:
ЭHNO3 TNaOH VNaOH VK 63 × 0,063 00 × 32 × 250
mHNO3 = ___________________________ ______ = ______________________________ = 0,992 г.
ЭNaOH VA 40,01 × 25
Пример 14. На титрование навески 0,2240 г технической соды в присутствии индикатора метилового оранжевого израсходовали 18 см3 стандартного раствор хлористоводородной кислоты с титром 0,003 646 г/см3. Рассчитать содержание Na2CO3 в исходной соде.
Решение. Используя формулу (12), запишем
ЭNa2CO3 THCl VHCl
100 % 70,01 × 0,003 646
× 18
. 100
ω Na2CO3 =________________________ __________ = ___________________________________= 3,13 %.
ЭHCl a Na2CO3 36,46 × 0,2240
Пример 15. Азотная кислота неизвестной концентрации разбавлена водой и доведена до метки в мерной колбе вместимостью 250 см3. На титрование 25 см3 полученного раствора израсходовано 32 см3 раствора едкого натра с TNaOH / HNO3 = 0,063 г/см3. Вычислить содержание азотной кислоты в граммах.
Решение. Согласно формуле (17)
VK 250
m HNO3 = TNaOH / HNO3 × VNaOH _______ = 0,063 × 32 _______ = 20,16 г.
VA 25
Различные методы в титриметрии
1. Метод кислотно-основного взаимодействия (метод нейтрализации)
Метод нейтрализации основан на применении реакции нейтрализации. Основное уравнение процесса нейтрализации в водных растворах:
Н3О+ + ОН – ® 2Н20
или Н+ + ОН – ®Н2О
Методы нейтрализации позволяют количественно определять кислоты, основания и другие вещества, реагирующие в стехиометрических отношениях с кислотами и основаниями в водных растворах.
Пользуясь каким-либо титрованным раствором, содержащим ионы гид-роксония, можно титровать основания; титрованными растворами оснований титруют кислоты.
Техника определения состоит в том, что к определенному количеству раствора основания (или кислоты) постепенно приливают из бюретки титрованный раствор кислоты (или основания) до наступления точки эквивалентности. Количество основания (или кислоты), содержащееся в исследуемом растворе, вычисляют по объему титрованного раствора кислоты (или основания), израсходованного на нейтрализацию определенного объема раствора анализируемого образца или навески исследуемого продукта.
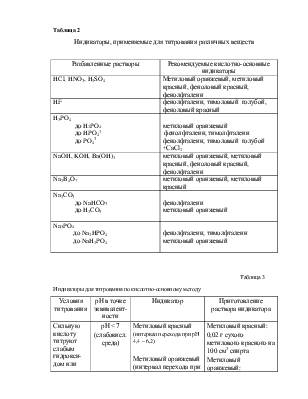
В качестве рабочих растворов в методе нейтрализации используют растворы кислот (главным образом, хлороводородной и серной) и щелочей (КОН и NaOH).
В методе кислотно-основного титрования встречаются следующие случаи титрования:
1.Сильная кислота титруется сильным основанием и наоборот.
2.Слабая кислота титруется сильным основанием.
3.Слабое основание титруется сильной кислотой.
В процессе титрования различают четыре этапа:
1)точку перед началом титрования;
2)титрование до точки эквивалентности;
3)точку эквивалентности;
4)титрование после точки эквивалентности.
В процессе кислотно-основного титрования изменяется концентрация ионов водорода в титруемом растворе. Это изменение можно представить графически в виде кривой титрования в координатах "объем стандартного раствора (см3) - рН титруемого раствора".
Для расчета кривой титрования нужно знать качественный состав раствора в титровальной колбе для каждого момента титрования и соответственно ему выбрать расчетное выражение.
Наиболее важный участок кривой титрования - участок вблизи точки эквивалентности, когда происходит изменение рН раствора. Это резкое изменение рН раствора называют скачком титрования. Скачок титрования наблюдается в пределах: оттитровано 99,9 % вещества - прибавлено 0,1 % избытка стандартного раствора. В точке эквивалентности может быть рН=7; рН > 7; рН < 7.
Если сила кислоты и основания одинакова, то в точке эквивалентности рН = 7, если сила кислоты меньше основания – рН > 7, если сила кислоты больше силы основания – рН < 7.
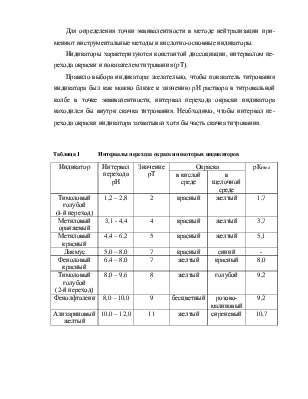
Для определения точки эквивалентности в методе нейтрализации применяют инструментальные методы и кислотно-основные индикаторы.
Индикаторы характеризуются константой диссоциации, интервалом перехода окраски и показателем титрования (рТ).
Правило выбора индикатора: желательно, чтобы показатель титрования индикатора был как можно ближе к значению рН раствора в титровальной колбе в точке эквивалентности, интервал перехода окраски индикатора находился бы внутри скачка титрования. Необходимо, чтобы интервал перехода окраски индикатора захватывал хотя бы часть скачка титрования.
|
Индикатор |
Интервал перехода рН |
Значение рТ |
Окраска |
рКHInd |
|
|
в кислой среде |
в щелочной среде |
||||
|
Тимоловый голубой (I-й переход) |
1,2 – 2,8 |
2 |
красный |
желтый |
1,7 |
|
Метиловый оранжевый |
3,1 - 4,4 |
4 |
красный |
желтый |
3,7 |
|
Метиловый красный |
4,4 – 6,2 |
5 |
красный |
желтый |
5,1 |
|
Лакмус |
5,0 – 8,0 |
7 |
красный |
синий |
- |
|
Феноловый красный |
6,4 – 8,0 |
7 |
желтый |
красный |
8,0 |
|
Тимоловый голубой (2-й переход) |
8,0 – 9,6 |
8 |
желтый |
голубой |
9,2 |
|
Фенолфталеин |
8,0 – 10,0 |
9 |
бесцветный |
розово-малиновый |
9,2 |
|
Ализариновый желтый |
10,0 – 12,0 |
11 |
желтый |
сиреневый |
10,7 |
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.