Индикаторы, применяемые для титрования различных веществ
|
Разбавленные растворы |
Рекомендуемые кислотно-основные индикаторы |
|
HCl, HNO3, H2SO4 |
Метиловый оранжевый, метиловый красный, феноловый красный, фенолфталеин |
|
HF |
фенолфталеин, тимоловый голубой, феноловый красный |
|
H3PO4 до H2PO4– до HPO42– до PO43– |
метиловый оранжевый фенолфталеин, тимолфталеин фенолфталеин, тимоловый голубой +СаСl2 |
|
NaOH, KOH, Ba(OH)2 |
метиловый оранжевый, метиловый красный, феноловый красный, фенолфталеин |
|
Na2B4O7 |
метиловый оранжевый, метиловый красный |
|
Na2CO3 до NaHCO3 до H2CO3 |
фенолфталеин метиловый оранжевый |
|
Na3PO4 до Na2HPO4 до NaH2PO4 |
фенолфталеин, тимолфталеин метиловый оранжевый |
|
Условия титрования |
рН в точке эквивалент-ности |
Индикатор |
Приготовление раствора индикатора |
|
Сильную кислоту титруют слабым гидрокси-дом или слабый гидроксид титруют сильной кислотой |
рН < 7 (слабокисл. среда) |
Метиловый красный (интервал перехода при рН 4,4 – 6,2) Метиловый оранжевый (интервал перехода при рН 3,1 – 4,4) Лакмус (интервал перехода при рН 5,0 – 8,0) |
Метиловый красный: 0,02 г сухого метилового красного на 100 см3 спирта Метиловый оранжевый: 0,05г метилового оранжевого на 100 см3 воды Лакмус: 1,90 г сухого лакмуса на 100 см3 воды |
|
Слабую кислоту титруют сильным гидрокси- дом или сильный гидроксид титруют слабой кислотой |
рН > 7 (слабощелочная среда) |
Фенолфталеин (интервал перехода при рН 8,0 – 10) |
Фенолфталеин: 1 г сухого фенолфталеина на 100 см3 спирта |
|
Сильную кислоту титруют сильным гидрокси-дом или сильный гидроксид титруют сильной кислотой |
рН = 7 |
Лакмус, метиловый оранжевый, метиловый красный, фенолфталеин, нейтральный красный |
Нейтральный красный: 0,1 г сухого нейтрального красного на 70 см3 спирта + 30 см3 воды |
При выполнении анализов стандартизацию рабочих растворов проводят двумя способами: пипетированием и методом отдельных навесок.
Пипетирование заключается в следующем: на аналитических весах взвешивают навеску вещества, полностью переносят ее через воронку в мерную колбу, растворяют в небольшом количестве воды, раствор разбавляют водой до метки. Колбу закрывают и тщательно перемешивают. Аликвоту этого раствора отбирают пипеткой, помещают в коническую колбу и титруют. Проводят титрование трех одинаковых аликвот и для расчета берут средний результат (объем стандартного раствора, пошедшего на титрование).
При титровании отдельных навесок поступают следующим образом. Точную навеску вещества, рассчитанную на одно титрование, взвешивают на часовом стекле или в стакане объемом 100 - 150 см3, растворяют в небольшом объеме воды (20 - 30 см3) и оттитровывают. При этом способе титрования необходимо брать не менее двух навесок и вычислять среднее значение концентрации приготовленного раствора.
Способ отдельных навесок по сравнению со способом пипетирования более трудоемкий, но он более точен вследствие избежания ошибок, связанных с неточностью объема мерной колбы.
При измерении объемов необходимо помнить, что нельзя измерять малые объемы большими измерительными сосудами, а на титрование нельзя брать объемы раствора меньше 20 см3.
2. Перманганатометрический метод.
Метод перманганатометрии основан на окислении различных восстановителей раствором КМnО4, при этом Мn (VII) в составе иона МnО4– восстанавливается или до Мn (VI), или до Мn (IV), или до Мn (II). Степень восстановления марганца, а следовательно, и окислительные свойства раствора перманганата калия в большой степени зависят от среды, в которой протекает реакция. Так, в кислой среде Мn (VII) восстанавливается до Мn (II) по реакции:
МnО4– + 5е + 8Н+ = Мn2+ + 4Н2O Е° = + 1.51 В.
В слабощелочной и нейтральной - до Мn (IV), продуктом восстановления является МnO2 или Н2МnO3, которые выпадают в виде бурого осадка:
МnO4– + 3е + 2Н2O = МnО2¯ + 4OH– Е° = + 0,57 В.
В сильнощелочной среде - до Мn (VI):
МnO4– + e = МnO42– Е° = + 0,54 В
Так как окислительная способность КМnО4 в кислой среде выше, чем в нейтральной и щелочной средах, перманганатометрические определения чаще всего проводят в кислой среде.
Окислительно-восстановительные потенциалы указанных выше систем выражаются уравнением:
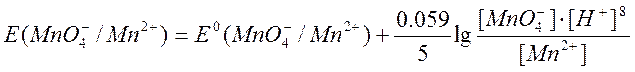
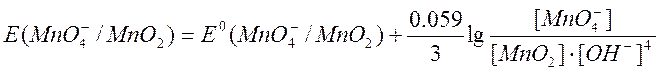
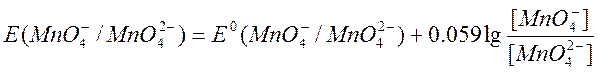
Из приведенных уравнений видно, что ![]() и
и ![]() в значительной степени зависят от [Н+]
или [ОН–], a
в значительной степени зависят от [Н+]
или [ОН–], a![]() практически не зависит от среды раствора. В связи с высоким
окислительным потенциалом КМnО4
в кислой среде его можно применять для окисления почти всех веществ, способных
окисляться.
практически не зависит от среды раствора. В связи с высоким
окислительным потенциалом КМnО4
в кислой среде его можно применять для окисления почти всех веществ, способных
окисляться.
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.