
































ОРГАНИЗАЦИЯ КЛИНИЧЕСКИХ ИССЛЕДОВАНИЙ
Принципы проведения клинического исследования
1. Постановка вопроса 2. Разработка протокола КИ 3. Определение дизайна КИ 4.Определение объёма выборки 4. Определение продолжительности КИ 5. Отработка критериев включения и исключения больных 6. Оценка эффективности 7. Оценка безопасности 8. Определение процедуры статистической обработки 9. Предоставление протокола КИ в органы государственного контроля и этический комитет 10.Непосредственное проведение КИ 11.Анализ полученных данных 12.Формулирование выводов и публикация результатов исследования
План клинического исследования
1. Включение пациента с добровольным согласием 2. Долечебный период (скрининг, рандомизация) 3. Определение критериев исходных состояний 4. Ликвидационный (отмывочный период). 5. Лечебный период.
Протокол клинического исследования
Протокол КИ является документом, все положения которого обязательны для исполнения всеми участниками исследования. Основные пункты протокола КИ: - научное обоснование цели исследования; - описание процедур; - описание последовательности действий
Протокол КИ определяет:
1. Исследуемое лекарственное средство и диапазон дозирования 2. Контрольный препарат, в т.ч. плацебо 3. Группу пациентов 4. Критерии безопасности и эффективности 5.Способы оценки результатов
Оценка соблюдения протокола
1. Проверка критериев включения и исключения пациентов 2. Соблюдение графика и полноты методов обследования 3. Проверка процедуры рандомизации (если таковая применялась) 4. Проверка процедур хранения, подготовки и назначения препарата 5. Проверка критериев эффективности и безопасности 6. Проверка сопутствующей терапии
Добровольное информированное согласие
Его получение проводится этическим комитетом и включает рассмотрение следующих вопросов: 1. Раскрытие и адекватное понимание информации. 2. Добровольный выбор 3. Стимулирование к участию в КИ ИНФОРМИРОВАННОЕ СОГЛАСИЕ: - должно быть получено у всех пациентов, включенных в КИ - должно быть получено до начала проведение КИ - должна использоваться последняя версия ИС, одобренная ЭК - если форма ИС предполагает подпись свидетеля, это должно быть выполнено - пациенту должна быть выдана копия (1 экземпляр) ИС - в истории болезни (амбулаторной карте) должен быть отмечен факт получения ИС
Общие критерии ограничения включения пациентов в КИ:
1. Нетипичный характер заболевания 2. Наличие др. болезней, способных влиять на течение основного заболевания и эффективность лечения 3. Заведомо необычно плохой прогноз 4. Высокая вероятность несоблюдения предписанного лечения ( профессиональная занятость, низкий интеллект, пристрастие к алкоголю и т.д.) 5. Наличие противопоказаний к предписанному лечению
Вмешательство
Исследуемое вмешательство характеризуется тремя свойствами: 1. Практическая применимость. Применимо ли предлагаемое вмешательство в обычной клинической практике. 2. Сложность. В КИ применяют однокомпонентные высокоспецифичные виды вмешательств. Практикующим врачам часто приходится делать выбор из альтернативных видов лечения, включающих многие компоненты. 3. Эффективность. Достаточно ли изучаемое вмешательство отличается от альтернативных способов лечения, чтобы можно было ожидать существенного влияния на исход.
Группы сравнения
Наиболее характерные причины выпадения больных из КИ в процессе их проведения
1. Неправильное включение пациента в исследование 2. Подозрение на побочные эффекты экспериментального, реже - контрольного препарата 3. Снижение мотивации у пациента 4. Исключение по клиническим показаниям (беременность, сопутствующие заболевания и т.д.) 5. Невозможность последующего наблюдения 6. Смерть
Основные типы контроля:
1. Контроль исходного состояния 2. Плацебо - контроль 3. Контроль по архивной статистике (исторический) 4. Внешний контроль (сравнение с результатами, полученными в другой клинике)
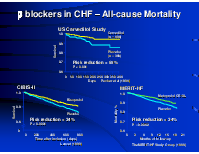
b blockers in CHF – All-cause Mortality
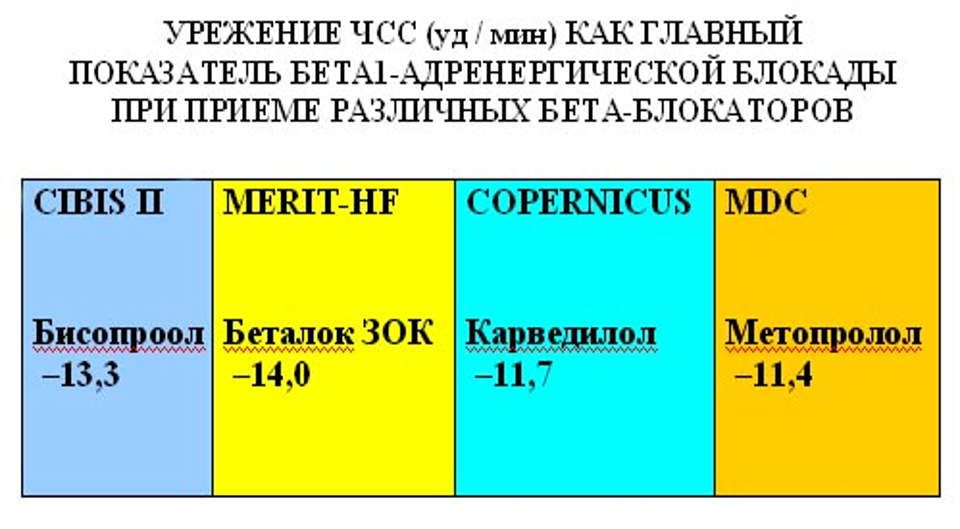
COPERNICUS
Рандомизация
Carvedilol (n=1156)
Больные с ХСН (ФВ<25%)
Placebo (n=1135)
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.