При малых H > 0 должны существовать источники энтропии, обусловливающие разделение углеводородов и воды. Основным источником энтропии при гидрофобных взаимодействиях служит упорядочение расположения молекул воды на гидрофобной поверхности. Компьютерное моделирование соседства воды и неполярной поверхности показывает, что происходит уменьшение энтропии в результате структуризации воды наподобие льда. Такое упорядочение воды в соседстве с неполярной поверхностью объясняется тем, что вода не способна формировать сильные водородные связи с углеводородом. Чтобы поддерживать энергетически выгодные водородные связи, молекулы воды должны как бы оседлать гидрофобную поверхность (рис.). Это ограничивает ориентацию молекул воды и снижает энтропию.
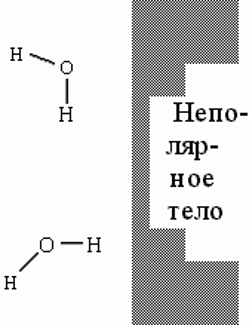
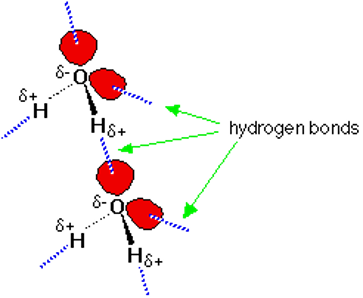
Молекулы H2O у поверхности неполярного тела. Верхняя молекула способна завязать обе Н-связи, но за ее "подходящее" расположение относительно поверхности приходится платить падением энтропии. Нижняя молекула теряет одну Н-связь с водой: ее О-Н группа смотрит прямо на неполярную преграду.
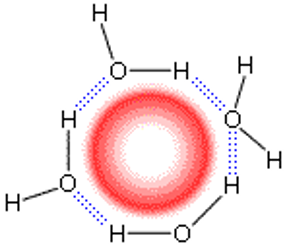
Схема нерегулярной упаковки связанных водородными связями молекул Н2О вокруг неполярной молекулы
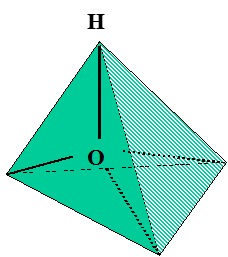
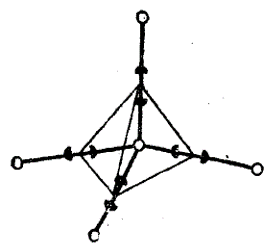
Другой подход к объяснению снижения энтропии воды у неполярной поверхности состоит в том, чтобы определить число возможных путей образования молекулой воды водородных связей с соседними молекулами. Если изобразить тетраэдр, образуемый водородными связями 4 молекул воды с центральной молекулой воды, можно видеть, что центральная молекула воды донирует свои атомы водорода в любую комбинацию 2 из 4 соседних молекул. Таким образом, имеется 6 путей образования полного числа водородных связей. Замена в этой пирамиде одной молекулы воды гидрофобной молекулой, не образующей водородных связей, приведет к уменьшению числа путей полного связывания примерно в два раза.
Свободная энергия гидрофобного эффекта составляет около +0.02 ккал/моль на каждый Å2 доступной поверхности неполярной молекулы, перенесенной из неполярного растворителя в воду. В частности: - для метана - G 2.6 ккал/моль при доступной поверхности примерно в 150 Å2; - для бензола - G 4.6 ккал/моль при доступной поверхности примерно в 200 Å2; - для циклогексана - G 6 ккал/моль при доступной поверхности примерно в 300 Å2.
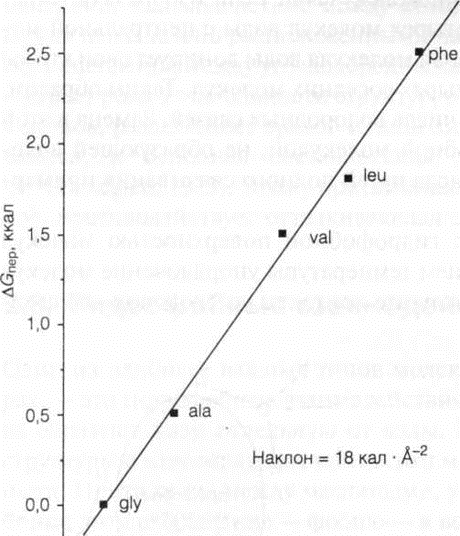
Зависимость свободной энергии переноса из воды в органический растворитель от площади поверхности боковой цепи аминокислоты.

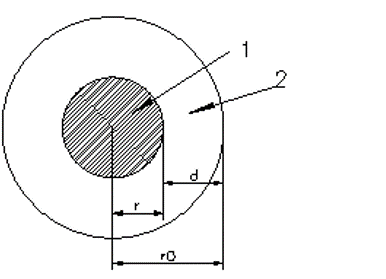
- гидрофобное ядро
- гидрофильная оболочка
В 1964 году Фишер установил, что, зная общее число аминокислотных остатков в ядре и отношение полярных остатков к неполярным, можно предсказать форму глобулы.
Для простоты будем считать, что все остатки имеют одинаковые объемы. Найдем отношение числа полярных остатков к неполярным, которое обозначим bs. Будем считать, что радиус глобулы r0, и глобула покрыта мономолекулярным слоем полярных остатков толщиной d (Фишер считал, что d ~ 4-5Ǻ). При сделанных допущениях отношение числа полярных и неполярных остатков равно отношению объемов сферического слоя и центрального ядра:
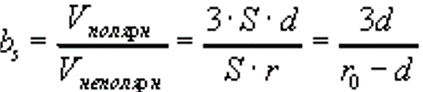
Следовательно, чем меньше r0, тем больше должна быть относительная гидрофильность белка.
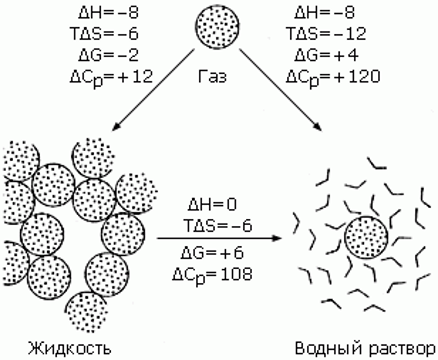
Термодинамика переноса неполярной молекулы циклогексана (СН2)6 из: - пара (вверху) в воду (справа), - в жидкий циклогексан (слева), и из него в воду. Цифры соответствуют процессам при 25оС (Т=300оК; RT = 0.6 ккал/моль). При 25оС энтальпия (H) переноса (СН2)6 из жидкого циклогексана в воду равно нулю.
H - изменение энтальпии в рассматриваемом переносе в расчете на моль молекул; S - соответствующее изменение энтропии (ТS - вклад изменения энтропии в свободную энергию; ккал/моль); G=H-ТS (ккал/моль) - это изменение свободной энергии Гиббса в расчете на моль переносимых молекул; CP [кал/(мольоК)] - изменение теплоемкости в расчете на моль переносимых молекул.
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.