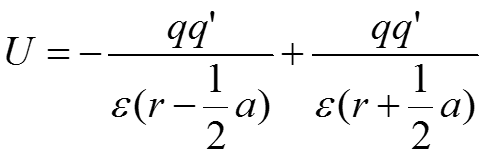
По мере сближения заряда и диполя r становится меньше а, в результате чего значимым остается только первое слагаемое. В этом случае взаимодействие приближается к кулоновскому взаимодействию с ближайшим зарядом диполя.
Взаимодействиями между диполями
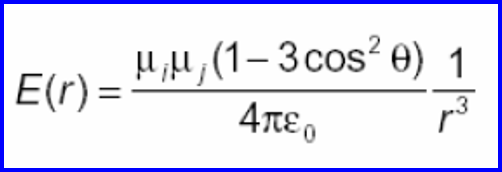
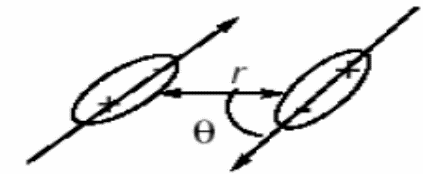

В растворе взаимодействующие молекулы могут вращаться, и тогда сила взаимодействия изменяется с изменением ориентации молекул. В этом случае становится необходимым усреднение по всем ориентациям. Вероятность данной ориентации задается тогда величиной статистического веса по Больцману е-U/kT. Вращение не только ослабляет взаимодействие, способствуя как энергетически выгодным, так и энергетически невыгодным взаимодействиям, но и укорачивает диапазон взаимодействия. Если использовать среднюю вероятность ориентации, рассчитанную с помощью распределения Больцмана, для вычисления средней энергии взаимодействия между двумя свободно вращающимися диполями с дипольными моментами 1 и 2, можно вывести следующее выражение
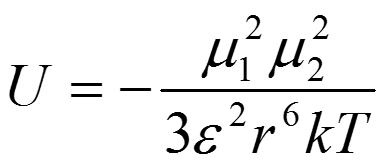
Индукционное (или поляризационное) взаимодействие
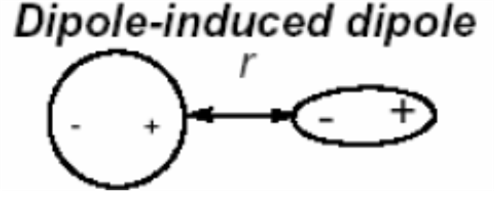
Напряженность поля в месте расположения одной из молекул и обусловлена распределением заряда второй молекулы с постоянным дипольным моментом.
Индуцированный дипольный момент выражается как произведение напряженности поля, Е, и величины поляризуемости, , отражающей свойство данной молекулы = E

Индуцированный постоянным зарядом q дипольный момент выражается как произведение напряженности поля, Е, и величины поляризуемости, , отражающей свойство данной молекулы = E
полагая Е = q/r2, получаем выражение для энергии как функции расстояния между зарядом и поляризуемой молекулой
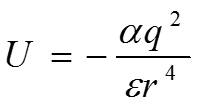
где cos = 1, поскольку индуцированный диполь считается ориентированным в направлении поля. В случае взаимодействия между постоянным диполем и индуцированным диполем за Е принимается поле диполя и энергия взаимодействия выражается как
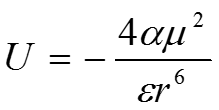
Взаимодействие катион--электроны
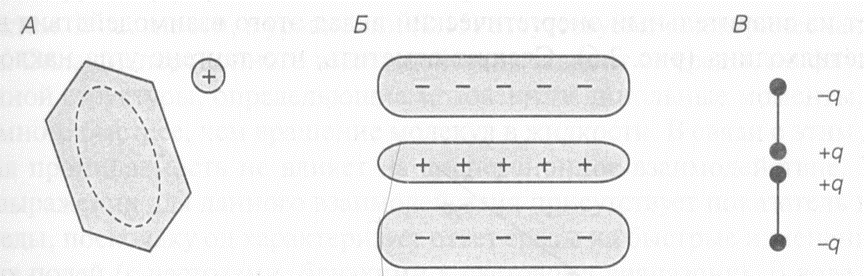
А. Комплекс молекулы бензола с катионом. Б. -Электроны бензольного кольца образуют два электроотрицательных слоя, между которыми лежит электроположительный слой в плоскости расположения ядер атомов углерода. В. Это распределение зарядов отражает модель квадруполя, образованного двумя диполями.
Между катионом и ароматическим кольцом при их сближении возникает сильное притяжение. Бензол в газовой фазе довольно прочно связывает катионы. Энергия связывания составляет 38 ккал•моль-1 в случае Li+ 28 ккал•моль-1 в случае Na+ 19 ккал•моль-1 в случае К+. Тот факт, что меньшие по размерам ионы связываются более прочно, указывает на простое электростатическое взаимодействие, при котором связывание имеет большую прочность при меньших размерах иона, поскольку в этом случае возможно большее сближение.
В белках взаимодействия катион—-электроны возможны в случае аминокислотных остатков, содержащих ароматическое кольцо (остатки фенилаланина, тирозина и триптофана). Эти аминокислотные остатки могут во многих случаях взаимодействовать с положительно заряженными боковыми цепями других аминокислотных остатков и присутствуют в связывающих участках для лигандов и субстратов, несущих положительный заряд. Теоретический расчет энергии взаимодействия катион—-электроны между метиламмонием и бензолом для неполярного растворителя -12,5 ккал/моль; в воде эта энергия уменьшается до -5,5 ккал/моль; метиламмонием и ацетатом для неполярного растворителя -53 ккал/моль; в воде эта энергия уменьшается -2,2 ккал/моль. Таким образом, в воде взаимодействие катион—-электроны сильнее, чем электростатическое взаимодействие между одновалентными ионами.
Дисперсионное взаимодействие
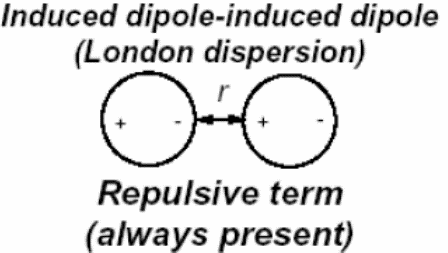
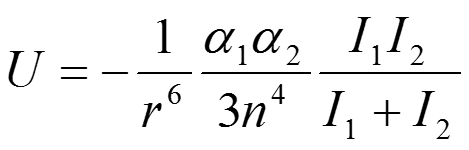
где 1 и 2 - поляризуемость двух взаимодействующих молекул, I1 и I2 — энергия ионизации и п — показатель преломления среды.
Суммарное ван-дер-Ваальсово взаимодействие Uориент+Uинд+Uдисперс
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.