Относительный вклад разных видов ван-дер-Ваальсовых сил для отдельных молекул
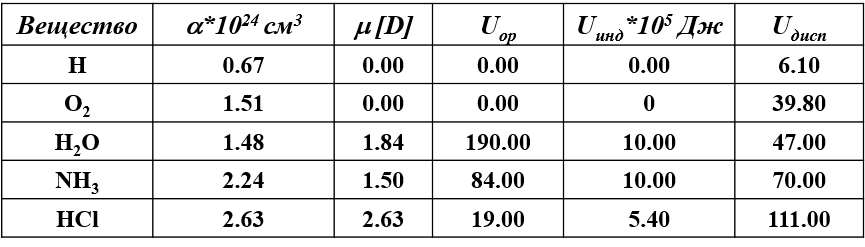
Для полимеров ван-дер-Ваальсово взаимодействие составляет от 4 до 100 кДж/моль.
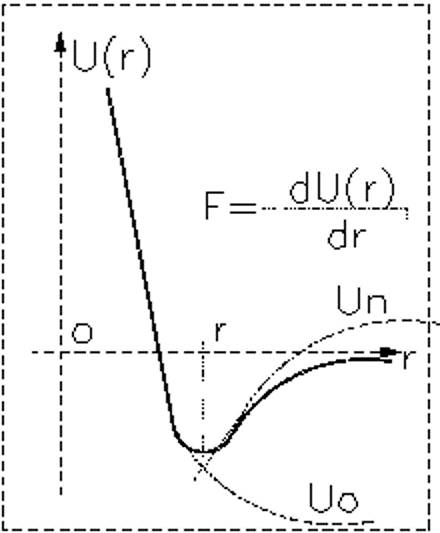
Стерическое отталкивание
Типичная зависимость потенциальной энергии взаимодействия U(r) двух частиц молекулярной природы можно представить в виде:
При малых расстояниях преобладает сила отталкивания, и Fотталк >0, при больших r преобладает сила притяжения. Общую энергию можно представить в виде: U(r)=Uотт(r) - Uпритяж(r). Минимум на графике соответствует равновесию.
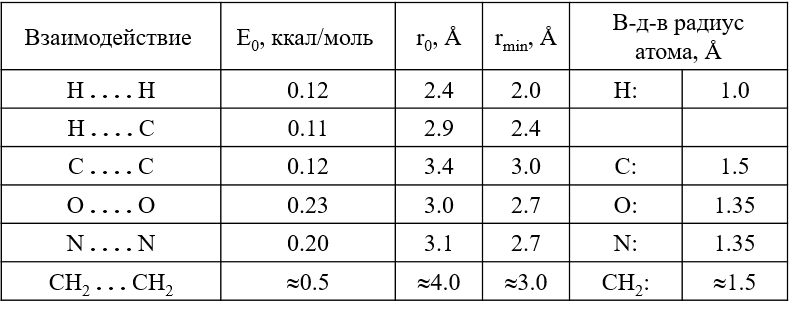
Характерные параметры потенциала Леннард-Джонса
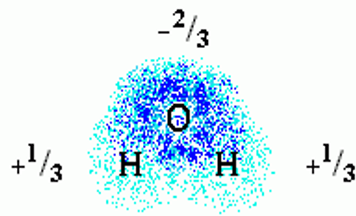
Водородная (Н-) связь
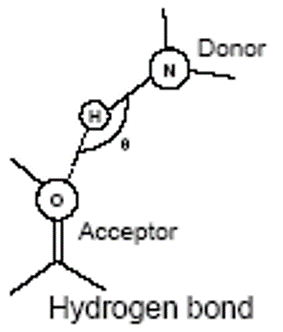
Водородные связи образуются между молекулой-донором водорода D–H и молекулой-акцептором A: D–H···A; расстояние между атомами D и A – 2,8 3,2 Å энергия Н-связи – 2 5 ккал/моль
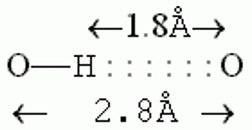
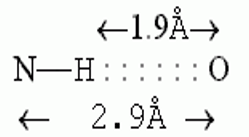
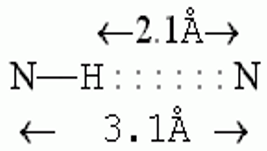
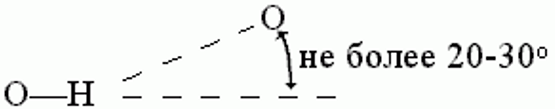
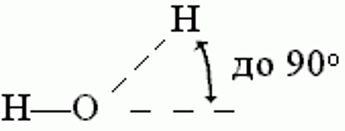
К ориентации акцепторной группировки водородная связь значительно менее чувствительна:

Энергия образования водородных связей
Для большинства биополимеров Uн связи лежит в пределах 12-35 кДж/моль
Физическая природа водородной связи. Экспериментальные и кванто-механические исследования показывают, что потенциальная энергия водородной связи имеет вид асимметричной кривой с двумя минимумами, локализованными вблизи отрицательных атомов, между которыми протон совершает туннельные переходы.
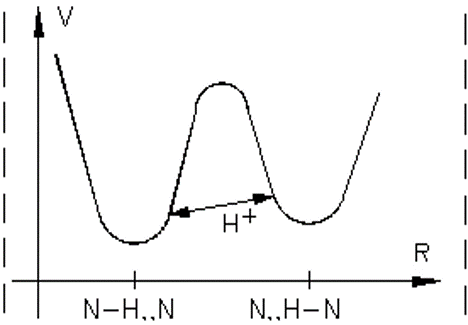
Потенциальная энергия водородной связи, соответствующая локализации протона около 2-х различных атомов азота.
Hеобходимо рассматривать образование водородной связи как обменную реакцию, а не просто как образование связи. Полное представление о процессе образования водородной связи между донором А и акцептором D
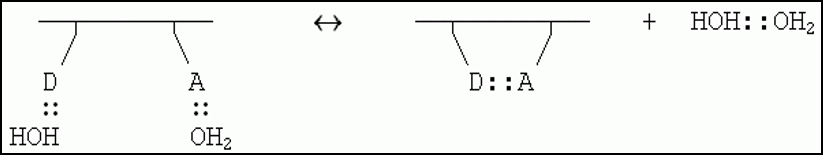
Энергетический баланс этой реакции близок к нулю: 2 Н-связи было, 2 стало. Однако энтропия воды возрастает.

Здесь EH < 0 - энергия Н-связи, SH > 0 - энтропия перемещений и вращения свободного тела, т.е. свободной молекулы Н2О или свободного димера НОH::OH2.
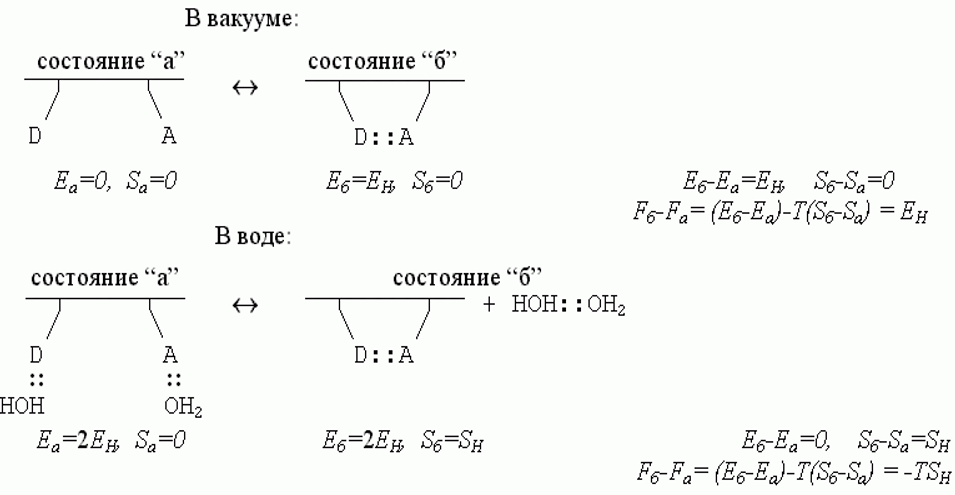
Рост S приводит к падению свободной энергии системы "белок в Н2О" на 1.5ккал/моль формирующихся внутрибелковых Н-связей D:::A.
Н-связи (воды с водой, воды с белком) стабильны, когда EH -TSH < 0 если EH -TSH > 0, т.е. они нестабильны, в этом случае это уже не жидкая вода, а пар.
Сравнение приведенных выше схем показывает, что Н-связи в белковой цепи становятся менее стабильными в водном окружении, чем в вакууме за счет изменения энтропии связывающейся воды; действительно, в водном окружении их свободная энергия Fб - Fа = -ТSH , то есть она меньше, чем в вакууме, где Fб - Fа= EH.
Причина этого видимого ослабления в том, что в водном окружении образовавшаяся внутри белковой цепи Н-связь замещает собой связь цепи с водой. И по той же причине Н-связи, стабилизующие структуру белка в воде, носят энтропийную, а не энергетическую природу: энергии двух состояний цепи (с внутрицепочечной связью и без нее) примерно равны, и из этих двух состояний с примерно равной энергией стабильнее та, где выше энтропия, т.е. где больше число микросостояний. А их больше у не связанной с белком молекулы воды.
Гидрофобные взаимодействия
При попытке объяснить гидрофобный эффект естественным фактором представляется дисперсионное взаимодействие. Но, будучи обусловлен дисперсионным взаимодействием, гидрофобный эффект должен был бы сопровождаться положительным изменением энтальпии, вызванным образованием контакта между гидрофобными молекулами и водой - H > 0. Для их смешивания должны были бы разрушаться сильные взаимодействия вода—вода и углеводород—углеводород и возникать слабые взаимодействия вода—углеводород, что сопровождалось бы поглощением теплоты. Вода и углеводороды слабо смешиваются, и калориметрические измерения показывают, что при этом происходит лишь очень незначительное изменение энтальпии, причем часто не с тем знаком. Соответственно для объяснения гидрофобного эффекта следует искать иные физические факторы.
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.