46. Зависимость константы скорости реакции от температуры.
С увелич-м температуры, скорость хим. р-ции обычно возрастает. В областях умеренных температур можно воспользоваться правилом Вант-Гоффа: при увеличении Т на 10ºС скорость реакции возрастает в 2-4 раза.
Наиболее широко применимое
уравнение Аррениуса: ![]()
Проинтегрировав Еа от
Т получим: k=A![]() (1),
где А-постоянная интегрирования- предэкспоненциальный множитель.
(1),
где А-постоянная интегрирования- предэкспоненциальный множитель.
Определив константы скоростей
при нескольких температурах, по (1) можно рассчитать А и Еа 2,3 lg ![]() , откуда
Еа=
, откуда
Еа=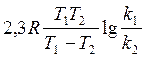 Определив Еа по (1) найдем
А.
Определив Еа по (1) найдем
А.
Уравнение (1) может быть
записано и в линейной форме: 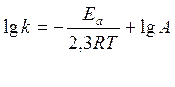
47. Вычисление константы скорости бимолекулярной реакции по числу соударений.
А+В ![]() С
С
К – константа скорости.
Для молекул разного сорта общее число бимолекулярных столкновений определяется по уравнению:
![]() ,
где
,
где
rAB – диаметр, равный сумме двух радиусов rA и rВ молекул А и В
n’A, n’B – число активных молекул газа в 1 см3
МА, МВ – молекулярные массы А и В
Величина средней арифметической скорости w определяется по формуле
![]()
Число активных молекул А и В может быть рассчитано по закону Больцмана
![]()
![]()
Число активных столкновений в 1 см3 в единице времени будет равно
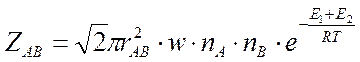 (5)
(5)
Суммарная энергия будет равна
Е = Е1 + Е2 (6)
Подставим (6) в (5)
![]()
Зная что
-(∂Ca/∂τ)v = ZAB/Ni
Ni = NA/22400
Ni – число молекул в 1 см3
![]() -число
молекул в 22400 см3
-число
молекул в 22400 см3
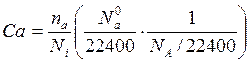
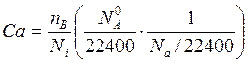
Согласно основному постулату кинетики
-(∂Ca/∂τ)v = KCaCB или -(∂Ca/∂τ)v = K∙nanB/(Ni)2 (*)
Подставим (*) в (8)
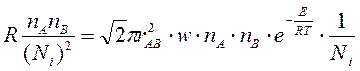 находим
К: К = К0e-E/RT,
находим
К: К = К0e-E/RT,
Где K0=![]()
48. Основные теории переходного состояния.
В модели активного комплекса предполагается, что исходная конфигурация реагирующих частиц, обладающих достаточной энергией для преодоления барьера реакции, преобразуется при непрерывном изменении межатомных расстояний и соответствующей энергии системы в активный комплекс, который обязательно превращается в продукты реакции:
АА + В → {ААВ}
 Для превращения исходных молекул АА и В в
продукты они должны образовать активный комплекс {ААВ}, в нем старые связи
разрыхлены и наметились новые, но их конфигурация и энергия не соответствуют
стабильным молекулам.
Для превращения исходных молекул АА и В в
продукты они должны образовать активный комплекс {ААВ}, в нем старые связи
разрыхлены и наметились новые, но их конфигурация и энергия не соответствуют
стабильным молекулам.
E1 и Е2 – энергия активации прямой и обратной реакций
∆Н = Е1-Е – теплота реакции
Вначале АА и В поднимаются до точки М, которая представляет собой энергетический перевал, затем активный комплекс распадается и молекулы А и АВ «скатываются вниз» в потенциальную яму.
Активный комплекс находится в состоянии равновесия с исходными веществами, причем одна из колебательных степеней свободы вырождается в поступательную по координатам реакции и дальше активный комплекс необратимо превращается в продукты. Прямой и обратный процессы с образованием активного комплекса протекают независимо друг от друга.
Скорость реакции согласно теории будет равна числу активных комплексов, проходящих через потенциальный барьер вдоль координаты реакции в единицу времени, в еденице реакционного пространства.
49. Связь константы скорости реакции с энтальпией и энтропией активации.
AB + С ![]() A…B…C
A…B…C![]() A + BC
A + BC
Выражение константы скорости для бимолекулярной реакции:
![]() (5), где χ – трансмиссионный коэффициент, определяет долю активных комплексов,
прошедших через точку М.
(5), где χ – трансмиссионный коэффициент, определяет долю активных комплексов,
прошедших через точку М.
Изменение энергии Гиббса для активных комплексов при стандартных условиях равно теплоте и энтропии активации или константе равновесия Кр#.
![]() ;
; ![]() =>
=> ![]() (6)
(6)
Подставив (5) в (6):
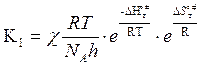 (7)
(7)
Используя уравнение Аррениуса: K1 = K01exp(-E/RT) и (7) можно найти связь между теплотой активации и энергией активации и выражение для K01:
Логарифмируем (7): 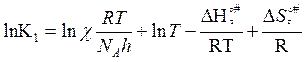
и дифференцируем по Т (∆S0#=const)
![]() ;
; ![]() (8)
(8)
Сравнивая с уравнением Аррениуса:
![]() =>
=>
![]() ;
; ![]() (9)
(9)
Подставляя (9) в (7):
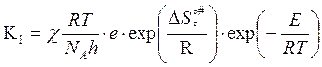 =>
=>
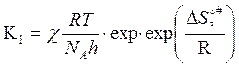
По величине ![]() реакции делят на «нормальные» (
реакции делят на «нормальные» (![]() =0, exp(
=0, exp(![]() /R)=1), «быстрые»
(
/R)=1), «быстрые»
(![]() >>0, exp(
>>0, exp(![]() /R)>>1) и
«медленные» (
/R)>>1) и
«медленные» (![]() <<0, exp(
<<0, exp(![]() /R)<<1).
/R)<<1).
exp(![]() /R)
приобретает смысл стерического множителя.
/R)
приобретает смысл стерического множителя.
50. Основные законы Фотохимии. Кинетика фотохимической реакции.
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.