11ix10 ??? по Л1
1. Как измерить истинную и среднюю скорость реакции
2. Как вероятность реакции зависит от энергии частиц
3. Изменяется ли скорость реакции в замкнутой системе
4. Связь между б/р концентрацией и степенью превращения
5. Когда выход продукта численно равен: а) селективности; б) конверсии
К понятию скорости: изменение состава реакционной смеси, т.е. Сi(t), регистрируют методами физико-химического анализа, например, по изменению давления, объема, плотности, показателя преломления, электро- и теплопроводности реакционной смеси.
К понятию селективности: Как правило, процессы, представляющие практический интерес, являются весьма сложными. Например, н-бутан при высокой температуре может изомеризоваться в изобутан, дегидрироваться в бутен и далее в бутадиен, крекироваться с образованием этилена, газов С1-С3, кокса и т.п. (рис. 3).
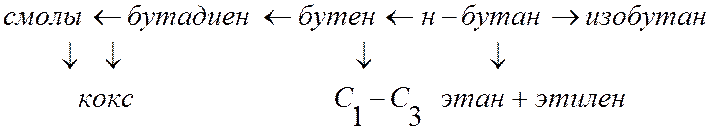
Рис. 3. Возможные варианты термического превращения н-бутана
Каждый из возможных вариантов превращения реагента называется маршрутом. В случае нескольких маршрутов вводится понятие селективности по продукту. В рассмотренном примере можно говорить о селективности по изобутану, бутену и др. продуктам.
Лекция 2
1.3 Факторы, влияющие на скорость химической реакции.Энергия активации, порядок реакции по реагентам и методы их определения
Основными факторами, влияющими на скорость химической реакции, являются температура и концентрация (давление) реагентов, а также наличие растворителя и катализатора (этому посвящены отдельные разделы). При изучении кинетики в реальных, макроскопических системах часто наблюдается зависимость скорости химической реакции от таких физических факторов, как скорость потока, вязкость и теплофизические свойства реакционной смеси, размер частиц реагента и катализатора. Однако эти явления изучает специальная дисциплина – макрокинетика.
Качественной характеристикой зависимости скорости реакции от температуры является температурный коэффициент реакции (предложен Вант-Гоффом), показывающий, во сколько раз возрастает скорость реакции при увеличении температуры на 10 градусов
![]() (10)
(10)
Величина γ составляет приблизительно 2 - 4 для различных типов реакций. Однако следует помнить, что правило Вант-Гоффа является эмпирическим, и единственной физически обоснованной характеристикой температурной зависимости скорости реакции является энергия активации.
Для вывода этой зависимости используем уравнение изобары химической реакции:
![]() (11)
(11)
где К= k1/k2 – константа равновесия, ![]() - теплота реакции, которую
представим, как разность двух величин А, имеющих размерность энергии. Тогда (11)
можно записать в виде:
- теплота реакции, которую
представим, как разность двух величин А, имеющих размерность энергии. Тогда (11)
можно записать в виде:
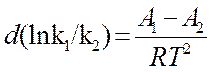 dT (12)
dT (12)
После интегрирования (12) получим
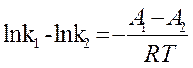 (13) или без индексов:
(13) или без индексов: ![]() + lnB, откуда
+ lnB, откуда
k= B•exp(-![]() ) (14)
) (14)
величина А, характеризующая зависимость константы скорости реакции от температуры, названа энергией активации Е и B– предэкспоненциальным множителем или k0.
Сопоставляя (11) и (13) найдем, что
E1 – Е2 = ΔН (15)
разность значений энергии активации реакции в прямом и обратном направлении равна тепловому эффекту реакции. Уравнение (15) отражает связь кинетики реакции с термодинамикой, что проиллюстрировано на рис. 3.
Отметим, что кинетика рассматривает движение реакционной системы через
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.