Определить, сколько времени потребуется для нагрева воды до
а) t2 = 100 oC; б)
t2
= 150 oC; в)
![]() оС
оС
Потерями теплоты в окружающую среду пренебречь. Изобарная теплоемкость воды cр = 4,19 кДж/(кг·К), плотность воды ρ = 103 кг/м3, 1 м3 = 103 л.
Рекомендации: использовать зависимости (2.9-2.11), а также (2.5), считать, что l =l’= 0.
Задача № 2.7
Определить количество произведенной работы рабочим телом – насыщенным паром массой 2 кг, если к нему подвели теплоту Q = (5600 + 10·n) кДж и при этом параметры пара после произведения работы имеют значение:
а) t2 = 120 oC; б) t2 = 100 oC; в) t2 = 130 oC.
Температура воды перед нагревом t1 = 20 oC, ее
теплоемкость ![]() кДж/(кг·К).
кДж/(кг·К).
Рекомендации: работа определяется по зависимости (2.9), удельная теплота находится из (2.10), изменение энтальпии Δh находится по (2.5) как разница энтальпий пара при температуре t2 (находится по табл. 5.1) и энтальпии воды при температуре t1 , находится по (2.6).
Задача № 2.8
Найти изменение энтропии ∆S
азота, если с начальных параметров температуры ![]() оС
и удельного объема
оС
и удельного объема
а) υ1 = 0,2 м3/кг; б)
υ1 = 0,5 м3/кг; в) υ1
= 0,7 м3/ кг произошло изменение температуры до ![]() ,
оС и удельного объема υ2 = 0,05 м3/кг
.
,
оС и удельного объема υ2 = 0,05 м3/кг
.
Рекомендации: изобарные теплоемкости рассчитать по табл. 2.1, изменение энтропии – по (2.7).
Тема 4. Термодинамические процессы
Основные процессы изменения состояния идеального газа:
- изохорный (υ = const); - изобарный (р = const); - изотермический (Т = const); - адиабатный (q = const).
Характеристики этих процессов приведены в таблице 4.1.
Таблица 4.1
Характеристики процессов изменения состояния
|
№ форм |
Процессы |
||||
|
изохорный |
изобарный |
изотермический |
адиабатный |
||
|
Уравнение процесса |
4.1 |
|
|
|
|
|
Теплоемкость кДж/(кг·К) |
4.2 |
сυ |
|
∞ |
0 |
|
Изменение внутренней энергии, ΔU, кДж/кг |
4.3 |
|
|
0 |
|
|
Изменение энтальпии, Δh, кДж/кг |
4.4 |
|
|
0 |
|
|
Уд. количество теплоты, q1-2, кДж/кг |
4.5 |
|
|
|
0 |
|
Работа изменения объема l1-2, кДж/кг |
4.6 |
0 |
|
|
|
![]()
![]() Уравнение
состояния идеального газа
Уравнение
состояния идеального газа
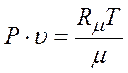 . (4.7)
. (4.7)
Плотность газа
r=1/υ, кг/м3, (4.8)
масса газа
m=r ·V, кг, (4.9)
где V- объем среды, м3.
Количество теплоты
Q=m ·q, кДж. (4.10)
Задача № 4.1
В закрытом сосуде емкостью V=300 л содержится азот при температуре t1= (20 +10·n) оС и давлении
а) Р1 = 0,8 МПа; б) Р1 = 1,2 МПа; в) Р1 = 1,5 МПа.
Определить давление, плотность и массу газа после охлаждения до 0 оС.
Рекомендации: для определения давления использовать соответствующее уравнение процесса (4.1, табл. 4.1), для определения плотности использовать уравнение состояния (4.7) и уравнение (4.8), 1 м3 = 103 л.
Задача № 4.2
В газовом баллоне емкостью V=40 л содержится углекислый газ при температуре t1= (20 +1,0·n) оС и давлении
а) Р1 = 8 МПа; б) Р1 = 12 МПа; в) Р1 = 15 МПа.
Определить массу и объем газа, если его выпустить в атмосферу при температуре 15 оС.
Рекомендации: по уравнению состояния (4.7) находятся удельные объемы газа для начальных (в баллоне) и конечных (в атмосфере) параметров, плотность находится по (4.8), масса по (4.9) по начальным параметрам, объем газа в атмосфере – по (4.9) по конечным параметрам (при условии, что m=const).
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.