Энтальпия – функция состояния термодинамической системы, равная сумме внутренней энергии и произведения удельного объема на давление
![]() .
.
Энтальпия идеального газа зависит только от температуры. Изменение энтальпии рассчитывается по изобарной теплоемкости по зависимости (кДж/кг)
![]() , (2.9)
, (2.9)
где ср – изобарная теплоемкость, кДж/кг·К; ΔТ=Δt – изменение абсолютной (К) и обычной (оС) температуры.
Теплоемкость может находиться по таблицам или рассчитываться по зависимости (кДж/кг)
![]() , (2.10)
, (2.10)
гдеt – оС.
Изменение энтропии газа рассчитывается по зависимости (кДж/кг·K)
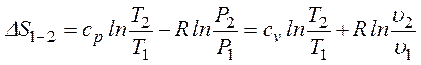 ,
(2.11)
,
(2.11)
где Р1 , Р2 – давления (Па) при температурах T1 и T2 (К), υ2, υ1 – удельные объемы газа, м3/кг.
Первый закон термодинамики
![]() ,
(2.12)
,
(2.12)
где q – подведенная теплота, кДж/кг; ΔU, Δh – изменение внутренней энергии или энтальпии, кДж/кг; l, l’ – механическая работа изменения объема и работа изменения давления (потока газов), кДж/кг.
Полная теплота для m(кг) массы тела находится из
![]() , кДж (2.13)
, кДж (2.13)
Тепловая мощность находится из зависимости
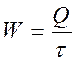 [кДж/с = кВт]. (2.14)
[кДж/с = кВт]. (2.14)
Задача № 2.1.
Определить изохорную массовую ![]() теплоемкость
газа при температуре
теплоемкость
газа при температуре ![]() оС:
оС:
а) азота; б) окиси углерода; в) двуокиси углерода.
Рекомендации: изобарная теплоемкость определяется из табл. 2.1, газовая постоянная этого газа R определяется из (2.3), а изохорная теплоемкость из (2.2); атомные массы азота ma=14 кг/кмоль, углерода ma=12 кг/кмоль, кислорода ma=16 кг/кмоль.
Задача № 2.2
Найти среднюю массовую изохорную теплоемкость ![]() для воздуха в интервале температур
от:
для воздуха в интервале температур
от:
а) ![]() оС; б)
оС; б)
![]() оС; в)
оС; в)
![]() оС до
оС до ![]() оС, объемный состав
воздуха: кислород - 21 %, азот - 78 %, углекислый газ – 3 % .
оС, объемный состав
воздуха: кислород - 21 %, азот - 78 %, углекислый газ – 3 % .
Рекомендации: аналогично задаче № 2.1 рассчитать массовые изобарные теплоемкости для каждого газа при температурах t1 и t2, найти среднюю теплоемкость. Рассчитать объемные доли каждого газа (2.5), найти теплоемкость (2.7) и молекулярную массу (2.6) смеси, затем по (2.1) и (2.2) рассчитывается массовая изохорная теплоемкость, по (2.4) находится ее удельный объем и по (1.14) плотность.
Задача № 2.3
Объемный состав продуктов сгорания топлива ![]() %;
%; ![]() %,
%,
![]() - остальное, %. Определить удельный
объем, плотность и объемную изобарную теплоемкость этой смеси газов при
температуре:
- остальное, %. Определить удельный
объем, плотность и объемную изобарную теплоемкость этой смеси газов при
температуре:
а) 600 оС; б)
800 оС ; в) ![]() оС
оС
и давлении 750 мм рт.ст.
Рекомендации: объемная доля каждой составляющей газа
определяется по (2.12), здесь ![]() %, молекулярная
масса и теплоемкость смеси определяется по (2.13)и (2.14), удельный объем
определяется по (2.8), плотность – по (1.14).
%, молекулярная
масса и теплоемкость смеси определяется по (2.13)и (2.14), удельный объем
определяется по (2.8), плотность – по (1.14).
Задача № 2.4
В двух баллонах объемом V=40 л каждый содержатся смеси газов: азота с
двуокисью углерода (в одном) и азота с кислородом (в другом), объемное содержание
азота ![]() %. Определить, во сколько масса
одной смеси больше другой, если в обоих баллонах установлены следующие
параметры:
%. Определить, во сколько масса
одной смеси больше другой, если в обоих баллонах установлены следующие
параметры:
а) 60 оС б) 80 оС ; в) 100 оС
Р=80 ат; Р=120 ат; Р=150 ат.
Рекомендации: определить объемные доли (2.5) и молекулярные массы (2.6) смесей, из (2.4) найти удельные объемы и массы смесей газов.
Задача № 2.5
Найти изменение массовой внутренней энергии и энтальпии 4 кг кислорода, если его температура изменяется с
а) ![]() оС;
б)
оС;
б) ![]() оС; в)
оС; в)
![]() оС до температуры
оС до температуры ![]() оС .
Учесть зависимости теплоемкости от температуры.
оС .
Учесть зависимости теплоемкости от температуры.
Рекомендации: аналогично задаче № 2.1 находится изохорная массовая теплоемкость кислорода, по зависимостям (2.1) и (2.5) находятся удельные внутренняя энергия и энтальпия газа, затем эти же параметры находятся для полной массы газа.
Задача № 2.6
В сосуд с 5-ю литрами воды при температуре t1 = 20 oС помещен электрический нагреватель с мощностью
![]() Вт.
Вт.
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.