Как отмечалось выше, гидродинамика является основой структуры химико-технологических аппаратов и обеспечивает определенную унификацию их математических описаний. Это позволяет в соответствии с «блочным принципом» формализовать компоновку математических описаний химико-технологических аппаратов из типовых «модельных блоков» с учетом принятых допущений.
В химико-технологических аппаратах вещества переносятся с материальными потоками и претерпевают различные превращения. При этом концентрации и температуры могут изменяться в каждой точке реактора как в зависимости от гидродинамической структуры потока, так и от вида реакции и теплообмена. Для учета указанных явлений основные уравнения модели химического реактора должны быть дополнены уравнениями кинетики реакции и теплообменного процесса.
Применение принципа сохранения
вещества необходимо для расчетов любого реактора. Материальный баланс для
любого вещества, принимающего участие в реакции, например для компонента ![]() , можно записать в виде:
, можно записать в виде:
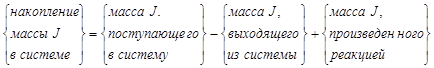 .
.
Если это уравнение записать для определенного промежутка времени, все слагаемые будут иметь размерность единиц массы.
Для практических целей, однако, удобнее
пользоваться единицами массы, отнесенными к единицам времени; в этом случае все
слагаемые представляют собой массовые скорости вещества ![]() .
.
Математическая запись уравнения материального баланса в значительной степени определяется природой исследуемой системы. В качестве основной для последующих расчетов мы выбираем такую систему, материальный баланс которой может быть записан в следующей форме:
![]() (7.1)
(7.1)
где ![]() -
масса
-
масса ![]() в системе;
в системе;
![]() - изменение
массового потока
- изменение
массового потока ![]() за счет конвекции и,
возможно, диффузии;
за счет конвекции и,
возможно, диффузии;
![]() - массовая скорость производства
- массовая скорость производства ![]() химической
реакцией, отнесенная к единице объема;
химической
реакцией, отнесенная к единице объема;
![]() —усредненная
величина
—усредненная
величина ![]() ;
;
![]() - объем системы.
- объем системы.
Сумма материальных балансов по каждому из химических веществ дает общий материальный баланс:
![]() кг/сек. (7.2)
кг/сек. (7.2)
Так как мы выражали количества различных компонентов в единицах массы, члены, определяющие изменение массы за счет реакции по уравнению (7.1), взаимно уничтожаются при суммировании. Это, безусловно, не обязательно при использовании других единиц (молей, единиц объема). Однако следует указать, что использование единиц массы при составлении материального баланса химического процесса вместе с мольными единицами требует большой осторожности.
Применение принципа сохранения энергии приводит к следующему общему виду энергетического баланса:
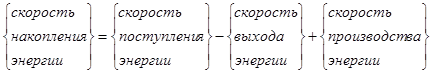 .
.
При строгом подходе нужно учитывать все формы энергии: тепловую кинетическую, потенциальную, энергию тяготения, энергию электрического и магнитного полей.
В большинстве случаев, однако, энергетический баланс системы, в которой протекает реакция, определяется тепловой энергией и работой. Поэтому его можно записать в виде:
![]() . (7.3)
. (7.3)
Здесь ![]() —
общая внутренняя энергия системы;
—
общая внутренняя энергия системы;
![]() - изменение
потока энтальпии;
- изменение
потока энтальпии;
![]() - скорость подвода тепла;
- скорость подвода тепла;
![]() - поток энергии
в окружающую среду.
- поток энергии
в окружающую среду.
Отметим, что для замкнутых систем (т. е. для систем, в которых отсутствует поток вещества внутрь системы или из нее) второй член уравнения (7.3) исчезает, поэтому окончательное уравнение эквивалентно первому закону термодинамики. Следует также иметь в виду, что энергетический баланс необходимо учитывать при любых величинах тепловых эффектов.
Обычно существует разница между суммой абсолютных энтальпии конечных и исходных продуктов реакции.
Тепловой эффект ![]() реакции
реакции
![]() определяется как тепло, полученное системой
при протекании реакции в направлении, указанном стрелкой, при постоянных
температуре и давлении.
определяется как тепло, полученное системой
при протекании реакции в направлении, указанном стрелкой, при постоянных
температуре и давлении.
Поэтому
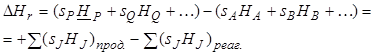 (7.4)
(7.4)
Это вытекает из энергетического
баланса для замкнутой системы в соответствии с первым законом термодинамики. ![]() положительно для эндо- и отрицательно
для экзотермических реакций.
положительно для эндо- и отрицательно
для экзотермических реакций.
Тепловой эффект какой-либо реакции можно рассчитать по тепловым эффектам других реакций, например по теплотам образования или теплотам сгорания всех компонентов реагирующей смеси.
При определении численной величины ![]() необходимо учитывать форму записи
необходимо учитывать форму записи
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.