Будем полагать в дальнейшем, что взаимодействия между кристаллами отсутствуют, а влияние фазы зародышей на перенос массы и энергии в смеси пренебрежимо мало.
С точки зрения механики сплошных сред каждая из выделенных нами фаз рассматривается как непрерывная. Тогда для каждой из фаз справедливы дифференциальные уравнения сохранения массы, импульса и энергии.
Запишем уравнения сохранения массы для фазы кристаллов объемом v и жидкой фазы:
для фазы кристаллов объемом ![]()
![]() , (12.28)
, (12.28)
для жидкой фазы
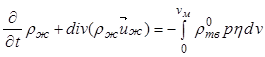 . (12.29)
. (12.29)
В ходе процесса кристаллизации уменьшение количества растворенной соли в растворе должно соответствовать количеству выделившихся кристаллов. Поэтому справедливо следующее уравнение сохранения массы соли в растворе:
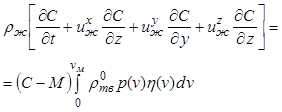 . (12.30)
. (12.30)
Здесь ![]() -
массовая концентрация соли в растворе;
-
массовая концентрация соли в растворе; ![]() -
отношение молекулярных весов безводной соли, к кристаллогидрату (если полученное
вещество безводное, то
-
отношение молекулярных весов безводной соли, к кристаллогидрату (если полученное
вещество безводное, то ![]() );
); ![]() ,
, ![]() -
соответственно векторы скоростей жидкой фазы и фазы кристаллов объемом
-
соответственно векторы скоростей жидкой фазы и фазы кристаллов объемом ![]() .
.
Для каждой из фаз гетерогенной смеси в ходе кристаллизации должен выполняться закон сохранения количества движения. Следовательно, можно записать соответствующие уравнения движения.
Уравнение движения
для фазы кристаллов объемом ![]() имеет вид
имеет вид
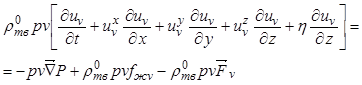 , (12.31)
, (12.31)
где ![]() -
внешняя массовая сила, приходящаяся на фазу кристаллов объемом
-
внешняя массовая сила, приходящаяся на фазу кристаллов объемом ![]() ;
; ![]() - архимедова сила.
- архимедова сила.
Сила взаимодействия между жидкой фазой
и кристаллами в первом приближении определяется силой трения между фазами ![]() , которая для кристаллов размером
, которая для кристаллов размером ![]() без учета стесненности составляет
без учета стесненности составляет
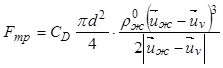 . (12.32)
. (12.32)
Для жидкой фазы уравнение движения в условиях пренебрежимо малых вязких напряжений записывается в виде
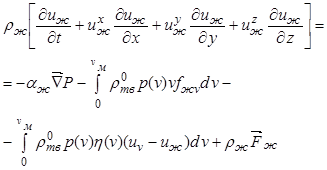 . (12.33)
. (12.33)
Здесь член 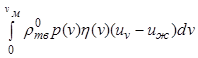 определяет
изменение количества движения жидкой фазы за счет фазового перехода, а
последний член
определяет
изменение количества движения жидкой фазы за счет фазового перехода, а
последний член ![]() - влияние
внешней массовой силы.
- влияние
внешней массовой силы.
Запишем теперь уравнения сохранения
энергии. Сначала выделим в качестве составляющей энергии многофазной смеси
поверхностную энергию ![]() . Тогда внутренняя
энергия смеси с учетом присутствующих фаз составит
. Тогда внутренняя
энергия смеси с учетом присутствующих фаз составит
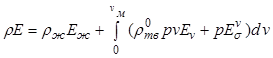 , (12.34)
, (12.34)
где ![]() -
поверхностная энергия сферической частицы объемом
-
поверхностная энергия сферической частицы объемом ![]() .
.
В дальнейшем при выводе уравнений
энергии каждой фазы будем пренебрегать работой внутренних сил. В этом случае изменение
внутренней энергии фазы будет определяться потоками теплоты, поступающими в
фазу и покидающими ее. Для фазы кристаллов объемом ![]() поток
теплоты, поступающий к фазе, выражается формулой
поток
теплоты, поступающий к фазе, выражается формулой
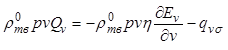 , (12.35)
, (12.35)
где первый член уравнения (11.164)
определяет теплоту, получаемую фазой кристаллов объемом ![]() при
переходе кристаллов из одной фазы в другую вследствие их роста, а второй член
соответствует потоку теплоты от фазы кристаллов объемом
при
переходе кристаллов из одной фазы в другую вследствие их роста, а второй член
соответствует потоку теплоты от фазы кристаллов объемом ![]() к
поверхности раздела фаз (не связанному с фазовым превращением). Так как
внутренняя энергия
к
поверхности раздела фаз (не связанному с фазовым превращением). Так как
внутренняя энергия ![]() изменяется во времени и
в пространстве с координатами (
изменяется во времени и
в пространстве с координатами (![]() ,
, ![]() ,
, ![]() ,
,
![]() ), то дифференциальное уравнение
сохранения внутренней энергии для фазы кристаллов объемом
), то дифференциальное уравнение
сохранения внутренней энергии для фазы кристаллов объемом ![]() запишется в виде
запишется в виде
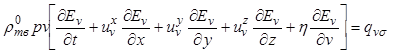 . (12.36)
. (12.36)
Поток теплоты ![]() ,
поступающий к жидкой фазе, определяется потоком теплоты
,
поступающий к жидкой фазе, определяется потоком теплоты ![]() от
жидкой фазы к поверхности раздела фаз:
от
жидкой фазы к поверхности раздела фаз:
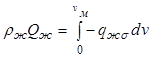 . (12.37)
. (12.37)
Тогда дифференциальное уравнение сохранения внутренней энергии для жидкой фазы примет вид
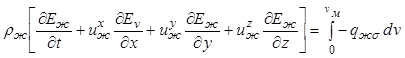 . (12.38)
. (12.38)
Наконец, поток теплоты, ![]() , поступающий к поверхности раздела
фазы кристаллов объемом
, поступающий к поверхности раздела
фазы кристаллов объемом ![]() , составляет
, составляет
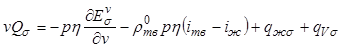 , (12.39)
, (12.39)
где первый член уравнения отражает изменение
поверхностной энергии кристаллов объемом ![]() вследствие
их роста, а второй - поток теплоты благодаря фазовому превращению (здесь
вследствие
их роста, а второй - поток теплоты благодаря фазовому превращению (здесь ![]() ,
, ![]() -
соответственно энтальпия жидкой фазы и фазы кристаллов).
-
соответственно энтальпия жидкой фазы и фазы кристаллов).
Соответствующее уравнение сохранения
внутренней энергии для поверхности раздела кристаллов объемом ![]() запишется в виде
запишется в виде
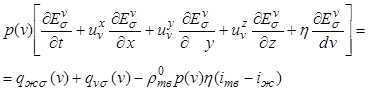 . (12.40)
. (12.40)
Введем соответствующие температуры фаз
![]() ,
, ![]() ,
,
![]() и следующие уравнения состояния:
и следующие уравнения состояния:
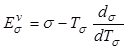 , (12.41)
, (12.41)
![]() , (12.42)
, (12.42)
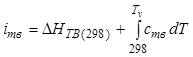 , (12.43)
, (12.43)
где ![]() ,
,
![]() ,
, ![]() -
температуры жидкой фазы, фазы кристаллов объемом
-
температуры жидкой фазы, фазы кристаллов объемом ![]() и
поверхности раздела фаз соответственно;
и
поверхности раздела фаз соответственно; ![]() -
теплота растворения при концентрации насыщения:
-
теплота растворения при концентрации насыщения: 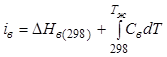 ;
; 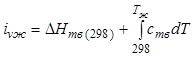 ;
;
![]() ,
, ![]() -
стандартные энтальпии воды и твердого вещества соответственно;
-
стандартные энтальпии воды и твердого вещества соответственно; ![]() ,
, ![]() -
удельные теплоемкости воды и кристаллизуемого вещества (предполагается, что
кристаллизация происходит в водном растворе).
-
удельные теплоемкости воды и кристаллизуемого вещества (предполагается, что
кристаллизация происходит в водном растворе).
Входящие в систему уравнений
математического описания процесса кристаллизации параметры ![]() и
и ![]() таковы:
таковы:
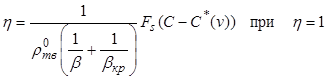 , (12.44)
, (12.44)
![]() . (12.45)
. (12.45)
Коэффициент массоотдачи ![]() можно определить из эмпирического
соотношения
можно определить из эмпирического
соотношения
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.