составы дез и х4), и прибавление его в жидкость (от состава *з До х4) вызывает повышение давления от рз до Рд. Слева от азеотропа более летучего компонента в паре больше, чем в жидкости, а справа - в паре меньше, чем в жидкости. Поэтому кривая зависимости у от х (см. рис. 6) проходит вначале выше диагональной прямой, потом ниже неё и пересекает её в точке азеотропа.
Системы, имеющие азеотропы, широко распространены, особенно азеотропы с max давления. Например, вода-этиловый спирт, бензол-уксусная кислота и т. д. Системы вода-муравьиная кислота, хлороформ-ацетон и др. имеют азеотропы с min давления.
До сих пор мы рассматривали диаграммы давление-состав, полученные при постоянной температуре. Но часто необходимо знать зависимость температуры кипения растворов от их составов при постоянном давлении, т. е. перейти от изотермической к изобарической диаграмме.
|
0,2 |
|
0,8 |
|
0,4 |
|
0,6 |
|
1.0 |
|
0,0 |
|
|
|
Рис. 11. Диаграмма состояния температура-состав для системы толуол-бензол при давлении 0.53 бар: / - кривая жидкости, 2 -кривая пара |
Так как компонент, обладающий меньшим давлением пара, кипит при более высокой температуре, кривые жидкости и пара на изобарической диаграмме меняются местами, т. е. кривая пара проходит выше кривой жидкости, поэтому область диаграммы, лежащей ниже кривой жидкости, отвечает жидкому состоянию, а область выше линии пара - парообразному. Между кривыми жидкости и пара лежит гетерогенная область, т. е. область сосуществования двух фаз. В качестве примера рассмотрим рис. 11, соответствующий изотермической диаграмме приведенной на рис. 7. Например, фигуративной точке системы Е с составом е (х2= е) и температурой кипения Т соответствуют две равновесные фазы (так как точка Е лежит в гетерогенной области) - жидкость состава а и пар состава Ь. Знаки производных 01' / cki и дР / g/xi противоположны, т. е. при увеличении со-
|
|
|
Рис. 12. Диаграмма состояния температура-состав для системы С2Н5ОН - ССЦ |
держания более летучего компонента 2 в растворе (от состава а до а\) давление пара над раствором возрастает, а температура кипения раствора понижается (от Т до ti). Соответственно пар богаче тем компонентом, прибавление которого к смеси уменьшает температуру кипения при данном давлении. В случае азеотропных смесей там, где на кривой давление-состав имеется max, на кривой температура кипения-состав находится min и наоборот. Другими словами изотермической диаграмме на рис. 9 соответствует изобарическая диаграмма на рис. 12.
Различие в составах паровой и жидкой фазы используется для разделения растворов на чистые компоненты и для очистки загрязненных веществ. Способность систем к разделению удобно выражать величиной относительной летучести компонентов а (коэффициент разделения). Относительная летучесть показывает, во сколько раз отношение концентраций компонентов в паре больше чем в жидкости
![]()
х/(\-х)
При этом принято брать отношение мольной доли более летучего компонента к мольной доле менее летучего.
В системах, не имеющих азеотропов, при сР/дс2 > О величина а всегда больше единицы, так как согласно первому закону Коновалова >>.? > хг, ayi <xi.
Используя законы Дальтона и Рауля, легко показать, что в идеальном растворе величина а = Р°/Р° = const, т.е. коэффициент разделения не зависит от состава. В реальных растворах при наличии в системе азеотропа величина а может быть меньше 1,
21
20
Эбулиометр является составной частью установки, используемой в данной задаче.
Для определения состава пара, сосуществующего с жидкостью, можно сконденсировать небольшое количество пара и определить состав конденсата. Но при этом концентрация легколетучего компонента в жидкости уменьшится и состав ее изменится. В результате мы получим состав пара, равновесного с жидкостью промежуточного состава (до и после отбора конденсата).
Неточность определения состава равновесных фаз может усугубляться еще тем, что конденсация пара при недостаточно тщательной теплоизоляции происходит не только в холодильнике, где пар целиком превращается в жидкость, но и на стенках прибора, в котором ведется исследование (частичная конденсация). При этом разница в составах пара и раствора, получается большей, чем при равновесии.
Для устранения этих недостатков разработано много приборов, где, во-первых, устанавливается равновесие между фазами и, во-вторых, устраняется частичная конденсация. На рис. 15 приведена схема
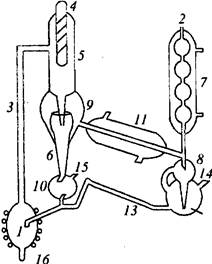 прибора, который
применяется в этой
работе. Исследуемая жидкость заливается
в куб 1 через отверстие
прибора, который
применяется в этой
работе. Исследуемая жидкость заливается
в куб 1 через отверстие
2, куб обогревается спиралью из нихрома, которая подключена к сети через ЛАТР. Парожидкостная смесь поднимается по трубке 3 и орошает термометрический карман
4. Для разделения жидкости и пара служит сепаратор 9. Жидкость по трубке б попадает в сборник
|
12 |
жидкости 10, откуда избыток жидкости стекает в куб. Пар, проходя через прямой холодильник
|
Рис. 15. Схема прибора |
11, конденсируется и через счетчик капель 8 попадает в резервуар 12,
соединенный с кубом шлангом 13,
по которому избыток дистиллята также стекает обратно в куб. При этом дистиллят все время
26
обновляется. В результате достаточно долгой работы состав дистиллята будет строго соответствовать составу пара, равновесного с жидкостью, находящейся в приборе. Состав жидкости в резервуаре 10 может значительно отличаться от исходного, поэтому жидкость также должна анализироваться. Пробы дистиллята и жидкости для анализа отбираются через отростки/-/ и 15. Прибор такой конструкции используют при изучении изобарических равновесий жидкость-пар. Чтобы получить давление, отличное от атмосферного, прибор присоединяют к маностату -устройству, обеспечивающему постоянство давлений. При атмосферном давлении-можно работать без маностата, так как небольшие колебания атмосферного давления сказываются на составах фаз незначительно.
Метод анализа. Для определения состава исследуемых проб жидкости и пара, можно использовать различные методы анализа: химические (титрование кислот, осаждение одного из компонентов и т. д.) или физико-химические (определение плотности, показателя преломления, ГЖХ и т. д.).
В данном случае наиболее удобным является метод определения состава по показателю преломления, так как он занимает мало времени и требует очень малого количества вещества. Точность этого метода тем выше, чем больше разница между показателями преломления компонентов смеси.
Предварительно в большом масштабе составляют калибровочную кривую - зависимость показателя преломления nD от состава раствора (мольной доли легколетучего компонента). Для этого измеряют показатели преломления чистых веществ и пяти-шести растворов известного состава (мольная доля ~ 0,1; 0,3; 0,5; 0,6; 0,7; 0,9). Для определения состава исследуемой бинарной смеси достаточно измерить её показатель преломления и восполь
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.