М Г Т У и м е н и Н. Э. Б а у м а н а
Лабораторная работа
по химии.
«p - металлы».
Факультет: НУК РЛМ
Группа: БМТ2 - 12
Дата выполнения: 19. 11. 2004
Дата сдачи: 26. 11. 2004
2 0 0 4
1. Цель работы.
Ознакомление со свойствами химических элементов, простыми веществами и соединениями бора и алюминия.
2. Теоретическая часть.
Алюминий Al.
Представляет собой амфотерный элемент, образующий простое вещество с металлическими свойствами. Металл имеет кристаллическую гранецентрированную кубическую решетку, хороший проводник тепла и электрического тока, весьма пластичен. На воздухе алюминий прочной оксидной пленкой Al2O3, предохраняющий его от дальнейшей коррозии. Наличие на поверхности алюминия прочного оксида не позволяет осуществить пайку алюминия низкотемпературными припоями. В подобных случаях возможно применение реактивно – флюсовой пайки, основанной на восстановлении металла из флюса, при этом металл становится припоем. Алюминий – металл активный. Если с алюминия снять оксидную пленку, он разлагает воду с выделением водорода:
2Al + 3H2O = Al2O3 + 3H2↑
Алюминий вытесняет водород из кислот слабых окислителей HCl.
2Al + 6HCl = 2AlCl3 + 3H2↑
Разбавленную азотную кислоту он восстанавливает до N2О и частично до NH3:
8Al + 30HNO3(p) = 8Al(NO3)3 + 3N2O + 15H2O
В концентрированных азотной и серной кислотах он не растворяется, так как образующийся Al2O3 не взаимодействует с концентрированными кислотами – окислителями.
Алюминий растворяется в щелочах, образуя гидроксосоли:
2Al + 6H2O + 2NaOH = 2Na[Al(OH)4] + 3H2↑
Алюминий является активным восстановителем, что проявляется, например, в его взаимодействии с KMnO4:
10Al + 6KMnO4 + 24H2SO4 = 5Al2(SO4)3 + 6MnSO4 + 3K2SO4 24H2O
Гидроксид алюминий Al(OH)3 – амфотерен. В кислой среде Al(OH)3 образует соли алюминия:
2Al(OH)3 + 3H2SO4 = Al2(SO4)3 + 6H2O
В щелочной среде – алюминаты:
Al(OH)3 + NaOH = Na[Al(OH)4]
Соли алюминия, будучи солями слабого основания, в водных растворах сильно гидролизованы и имеют кислую реакцию:
AlCl3 + H2O = Al(OH)Cl2 + HCl
Al(OH)Cl2 + H2O = Al(OH)2Cl + HCl
Алюминий способен к комплексообразовании. Для него характерны координационные числа 4 и 6:
[Al(OH)4]-; [Al(OH)6]3-; [Al(H2O)6]3+
Олово и свинец Snи Pb.
В виде простых веществ олово и свинец обладают ярко выраженными металлическими свойствами. Металличность у свинца выражена сильнее, чем у олова. Оба элемента проявляют степень окисления +2, +4, -4. Олово и свинец химически устойчивы, что обусловлено невысокими отрицательными значениями их электродных потенциалов, а также образованием на их поверхности защитных пленок оксидов и солей.
В мягкой воде при свободном доступе СО2 и О2 свинец постепенно растворяется вследствие образования растворимых гидрокарбонатов свинца. В соляной кислоте олово и свинец окисляются до 2+. Со свинцом эта реакция идет только в концентрированной кислоте и при нагревании, так как образующийся PbCl2 в холодной кислоте мало растворим:
Sn + HCl = SnCl2 + H2↑
Pb + HCl = H[PbCl3] + H2↑
Разбавленная серная кислота на олово, а особенно на свинец практически не действует вследствие образования пленки из малорастворимых солей PbSO4, SnSO4. В концентрированной серной кислоте олово и свинец окисляются:
Sn + 4H2SO4 = Sn(SO4)2 + 2SO2 + 4H2O
Pb + 3H2SO4 = Pb(HSO4)2 + SO2 + 2H2O
Олово и свинец с кислородом образуют моноксиды SnO, PbO и диоксиды SnO2, PbO2. В воде оксиды почти не растворимы, поэтому их гидроксиды получают действием щелочей на растворы соответствующих солей:
SnCl2 + 2NaOH = 2NaCl + Sn(OH)2
Pb(NO3)2 + 2NaOH = 2NaNO3 + Pb(OH)2
Sn(SO4)2 + 4NaOH = 2Na2SO4 + Sn(OH)4
Оксиды и гидроксиды олова и свинца амфотерны. Реагируя с избытком раствора щелочи, оксиды и гидроксиды этих металлов со степенью окисления +2 образуют соли – гидроксостаниты и гидроксопломбиты:
Pb(OH)2 + 2NaOH = Na2[Pb(OH)4]
Соли Sn (II) используются в качестве хороших восстановителей в различных средах, а для реакций окисления часто используются PbO2 и Pb3O4.
3. Практическая часть.
Опыт 1.
а) Название эксперимента.
Взаимодействие алюминия о щелочами.
б) Ход эксперимента.
Поместим в пробирку алюминий (стержень) Al и добавим 6 – 7 капель бесцветного раствора гидроксида натрия NaOH.
в) Наблюдения.
Сначала раствор становится розовым, бурно выделяется газ, затем раствор становится бесцветным.
г) Уравнения реакции.
2Al + 6H2O + 2NaOH = 2Na[Al(OH)4] + 3H2↑
Al0 - 3ē = Al+3 2 восстановитель реакция окисления
Н2+2 + 2ē = Н20 3 окислитель реакция восстановления
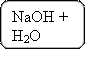 |
|||||||||
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.