












Новосибирский государственный университет
Факультет Естественных наук
Кафедра Физической Химии
Построение фазовой диаграммы бинарной системы KOH-NaOH.
Выполнил:
Ломовский Игорь
Будилкин Борис
Новосибирск
2006г.
Оглавление:
I Литературный обзор
1 - Твердые растворы. Правила Гиббса – Розебума 2
2 - Примеры фазовых диаграмм 4
II Цель работы 9
III Практическая часть.
1 - Принцип работы термовесов Netzch STA 449C Jupiter 10
2 - Получаемые данные 11
3 - Полученные данные 13
4 - Сравнение с литературными данными 14
IV Использованная литература. 15
Литературный обзор
Твердые растворы. Правила Гиббса – Розебума
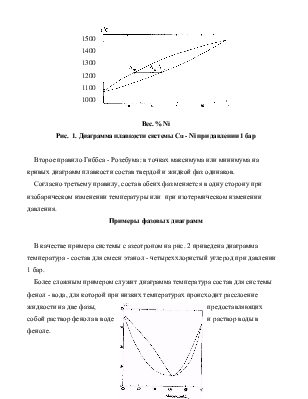
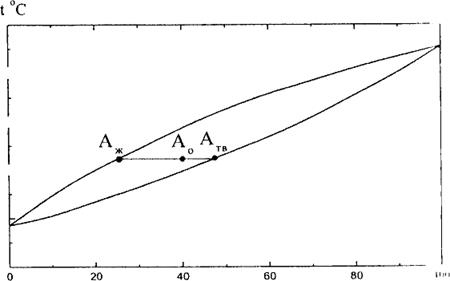
Рассмотрим системы, которые неограниченно смешиваются в жидкой фазе и совсем не смешиваются в твердой. Для систем, неограниченно смешивающихся в твердой и жидкой фазах, диаграмма состояний имеет вид, аналогичный равновесию в и системах жидкость - пар. Примером такой фазовой диаграммы может служить диаграмма равновесия жидкость – твердое (диаграмма плавкости), изображенная на рис. 1. Отношение количеств твердой и жидкой фаз в этом случае определяется по правилу рычага, например, для ситуации, изображенной на рис. 1:
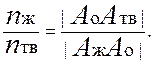
Из рис. 1 легко следует, что если состав расплава не совпадает с составом жидкой фазы, то можно производить разделение смеси путем последовательного расплавления и отделения твердых и жидких частей системы.
Термодинамическое описание систем жидкость - твердое совпадает с описанием систем жидкость - пар. Аналогично правилам Гиббса - Коновалова формулируются правила Гиббса - Розебума для описания равновесий в системах твердый раствор - жидкий раствор.
Первое правило Гиббса - Розебума гласит: жидкий раствор обогащен по сравнению с твердым раствором тем компонентом, прибавление которого к системе понижает температуру плавления.
1500
 1400
1400
1300
1200
1100
1000
Вес. % Ni
Рис. 1. Диаграмма плавкости системы Сu - Ni при давлении 1 бар
Второе правило Гиббса - Розебума: в точках максимума или минимума на кривых диаграмм плавкости состав твердой и жидкой фаз одинаков.
Согласно третьему правилу, состав обеих фаз меняется в одну сторону при изобарическом изменении температуры или при изотермическом изменении давления.
Примеры фазовых диаграмм
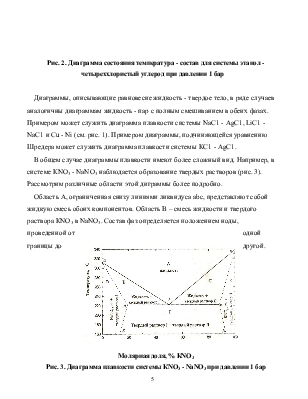
В качестве примера системы с азеотропом на рис. 2 приведена диаграмма температура - состав для смеси этанол - четыреххлористый углерод при давлении 1 бар.
Более сложным примером служит диаграмма температура состав для системы фенол - вода, для которой при низких температурах происходит расслоение жидкости на две фазы, предоставляющих собой раствор фенола в воде и раствор воды в феноле.
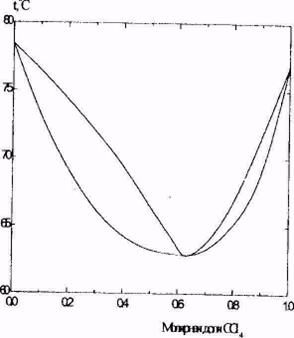
Рис. 2. Диаграмма состояния температура - состав для системы этанол - четыреххлористый углерод при давлении 1 бар
Диаграммы, описывающие равновесие жидкость - твердое тело, в ряде случаев аналогичны диаграммам жидкость - пар с полным смешиванием в обеих фазах. Примером может служить диаграмма плавкости системы NаС1 - АgС1, LiС1 - NаС1 и Сu - Ni (см. рис. 1). Примером диаграммы, подчиняющейся уравнению Шредера может служить диаграмма плавкости системы КС1 - АgС1.
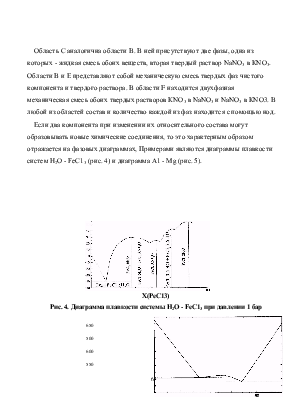
В общем случае диаграммы плавкости имеют более сложный вид. Например, в системе КNO3 - NaNО3 наблюдается образование твердых растворов (рис. 3). Рассмотрим различные области этой диграммы более подробно.
Область А, ограниченная снизу линиями ликвидуса аbс, представляют собой жидкую смесь обоих компонентов. Область В – смесь жидкости и твердого раствора КNО3 в NаNО3. Состав фаз определяется положением ноды, проведенной от одной границы до другой.
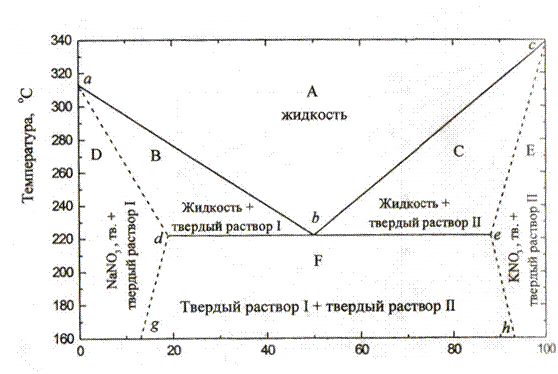
Молярная доля, % КNO3
Рис. 3. Диаграмма плавкости системы КNО3 - NаNО3 при давлении 1 бар
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.