Особенности лечения бесплодия при гиперандрогении
Т.В.Овсянникова, О.И.Глазкова Московская медицинская академия им. И.М.Сеченова (ректор - академик РАН, М.А.Пальцев), кафедра акушерства и гинекологии (зав. - член-корр. РАМН, И.С.Сидорова) ФППО, Москва
Гиперандрогения - одно из наиболее частых эндокринных нарушений, наблюдающееся у 5% женщин в популяции и у 3 5 -41 % пациенток, страдающих бесплодием, обусловленным хронической ановуляцией [1]. Гиперандрогения порождает целый комплекс проблем в различные периоды жизни женщины: снижение функции яичников па фоне НЛФ при регулярном менструальном цикле, нериулярпые менструации или их отсутствие, косметические проблемы (акне, гирсутизм) и практически всегда - бесплодие. Описан целый ряд состояний, при которых наблюдается хроническая ановуляция и гиперандрогения: яичниковая Гиперандрогения (СПКЯ), пейроэндокринно-обмен-ный синдром, врожденная дисфункция коры надпочечников (ВДКН - классическая и стертая формы), андроген-продуцирующие опухоли яичников или надпочечников, болезнь и синдром Кушинга, инсулинорезистентность, гиперпролактинемия, гипофункция щитовидной железы, прием препаратов, обладающих андрогенным действием [2]. Этапы терапии бесплодия при хронической гиперандрогении
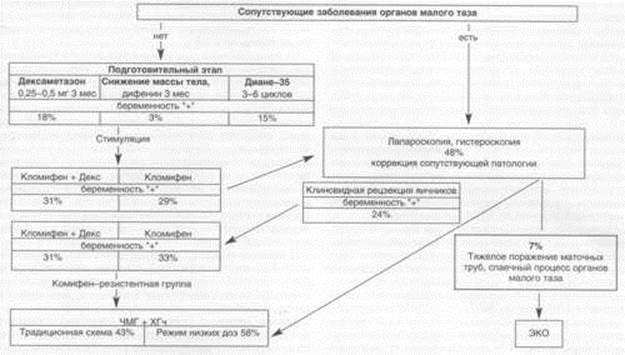
Результаты многочисленных исследований показывают, что истинную причину гиперандрогении установить крайне сложно [3]. RBarbieri (1990) сообщает, что у У/о обследованных пациенток с гиперадрогенией была выявлена недостаточность 21-гидроксилазы надпочечников, у 4% - опухоли яичников или надпочечников, синдром Ку-шинга и гиперпролактиемия. Более чем у 90% пациенток причину гиперандрогении выявить не удалось [1]. Нередко только по клиническим или лабораторным признакам при гиперандрогенной ановуляции ставят диагноз СПКЯ, что не всегда обосновано. СПКЯ - понятие, объединяющее гетерогенную популяцию пациенток как с ожирением, повышенным уровнем ЛГ, повышенным уровнем андрогенов, с наличием ультразвуковых признаков ПКЯ, так и с отсутствием этих нарушений. Предпринимаются попытки найти диагностические критерии, позволяющие определить основной источник повышенного уровня андрогенов [4]. Однако аналогичный спектр синтезируемых яичником и надпочечником андрогенов затрудняет определение источника гиперандрогении только по базальному уровню этих гормонов в плазме крови. Так, несмотря на то, что синтез ДГА-С происходит в основном в надпочечниках, у большинства женщин со стертой формой ВГКН отсутствует выраженное повышение уровня гормона. Напротив, у 50-60% женщин с СПКЯ при яичниковой гиперандрогении выявляются высокие концентрации ДГА-С [2, 3]. Сложность и многофакторность патогенеза хронической ановуляции и гиперандрогении объясняет трудности, возникающие при восстановлении менструальной и репродуктивной функции у этих больных. Так, именно у пациенток с гиперандрогенией наиболее часто наблюдается резистентность к терапии кломидом, а эффективность стимуляции овуляции препаратами ЧМГ почти в 2 раза ниже по сравнению с пациентками без гиперандрогении. Следует признать, что на сегодняшний день предлагается множество схем и препаратов для лечения бесплодия, хронической ановуляции и гиперандрогении, однако единых алгоритмов обследования и лечения данного контингента больных до настоящего времени не существует. Многолетний опыт наблюдения за пациентками с бесплодием и гиперандрогенией позволил нам предложить схему комплексной поэтапной терапии данной эндокринной патологии. Основными принципами при выборе тактики лечения бесплодия больных с хронической ановудяцией и гиперандрогенией являются: - оценка функционального состояния репродуктивной системы, наличия эндокринно-обменных нарушений, органической патологии органов малого таза; - предварительная подготовка пациенток; - тщательный клинико-лабораторный контроль процесса подготовки больной и последующей стимуляции овуляции. Последовательность применения терапевтических и хирургического методов восстановления репродуктивной функции и эффективность каждого из этапов лечения бесплодия у пациенток с хронической ановуляцией и гиперандрогенией представлены на рисунке. Подготовительный этап лечения проводится пациенткам с отсутствием сопутствующей патологии органов малого таза и включает: 1) снижение массы тела путем диетотерапии, физических нагрузок и лекарственных препаратов у пациенток с ожирением, нарушенной толерантностью к глюкозе в течение 3-6 мес; 2) применение комбинированных эстроген-гестагенов (в частности, препарата Диане-35) у пациенток со вторичной аменореей и высокими уровнями ЛГ и Тест не менее 3-6 циклов; 3) применение глюкокортикоидных препаратов (дек-саметазон 0,25—0,5 мг) у пациенток с высоким уровнем ДГА-С и гетерозиготным носительством гена недостаточности 21-гидроксилазы. Отечественные гинекологи считают снижение массы тела с помощью диеты и физических нагрузок обязательным этапом в терапии женщин с хронической ановуляцией и ожирением [5]. Исследования ряда авторов и наши наблюдения свидетельствуют о том, что наличие метаболических нарушений ухудшает результаты лечения бесплодия у пациенток с хронической ановуляцией и гиперандрогенией. Так, при нарушении толерантности к глюкозе стимуляция овуляции с применением кломида была в 3 раза ниже, чем у пациенток с нормальной толерантностью, а у кломи-фен-резистентных больных отмечены достоверно более высокие показатели индекса массы тела (ИМТ), чем у пациенток с хорошим стимулирующим эффектом и беременностью. Результаты стимуляции овуляции препаратами ЧМГ в режиме низких доз были значительно ниже у пациенток с висцеральным ожирением и нарушенной толерантностью к глюкозе, чем у пациенток без метаболических нарушений. Кроме того, этой группе больных требовалось большее количество препарата и более высокие дозы. Регуляция массы тела с помощью диетотерапии и физических нагрузок проведена у пациенток с ожирением различной степени, висцеральным распределением жировой ткани и у пациенток с нарушенной толерантностью к глюкозе. Больным с нейроэндокринно-обменным синдромом и явлениями гиперкортицизма дополнительно назначали дифенин по 117 г 3 раза в сутки. Добиться снижения массы тела более чем на 10% от исходной удалось у 77% пациенток, что привело к нормализации глюкозо-толерантного теста у подавляющего большинства больных (60%). Восстановлению регулярных овуляторных циклов на фоне нормализации массы тела произошло только у 1096 больных, беременность наступила лишь у 1 (3%) из них. Наиболее перспективной группой в плане восстановления менструальной и репродуктивной функции оказались пациентки с нейроэндокринно-обменным синдромом, возникшим после родов или аборта, с длительностью нарушений менструального цикла не более 6 лет, незначительным повышением уровня андрогенов и нормальной толерантностью к глюкозе. Результаты малоутешительные, но этот этап является необходимым и его следует рассматривать как подготовительный к последующей гормональной терапии, так как нормализация массы тела приводит к снижению концентрации андрогенов и повышению уровня тестосте-ронсвязывающего глобулина (ТЭСГ) [6]. Еще в начале 70-х годов комбинированные эстроген-гестагенные препараты были предложены при различных видах эндокриного бесплодия (и в частности, при СПКЯ) с целью нормализации гипоталамо-гипофизарно-яичниковых взаимоотношений, уменьшения числа зреющих фолликулов и размеров яичников. В ответ на отмену препаратов отмечалась стимуляция функции яичников по типу "ребаунд"-эффекта и наступление беременности. В настоящее время у пациенток с бесплодием на фоне гиперандрогении как яичникового, так и надпочечнико-вого генеза наиболее приемлемо и эффективно применение антиандрогенов - препаратов, избирательно подавляющих избыточную секрецию андрогенов яичниками и надпочечниками. Такой препарат известен в клинической практике годы под названием "Диане-35". Препарат выпускается в упаковке, содержащей 21 драже; составными компонентами являются 35 мг этинилэстрадиола и 2 мг ципротерона ацетата (ЦПА). Такое соотношение стероидов в настоящее время считается наиболее оптимальным и безопасным как для лечения гиперандрогенных состояний с/без бесплодия, так в целях контрацепции. Диане-35 нормализует менструальный цикл, снижая уровень ЛГ и андрогенов до нормальных показателей. У пациенток с нейроэндокринной патологией в целях снижения риска влияния на гиперинсулинемию и дислипиде-мию назначение Диане-35 целесообразно после нормализации массы тела и метаболических нарушений. Препарат назначают по классической для лечения бесплодия схеме, с 1 -го дня менструального цикла или индуцированной менструальноподобной реакции в течение 21 дня с последующим перерывом 7 дней. Нерерывность терапии при лечении бесплодия в сочетании с различной эндокринной патологией не должна превышать 6 мес. Оптимальным считается прием препарата в течение 3 мес под контролем изменения индекса ЛГ/ФСГ и уровня андрогенов по сравнению с их исходными показателями. Нормализация этих гормональных параметров происходит, как правило, уже к 3-му месяцу приема препарата, что на 43% снижает гирсутизм и приводит к значительному уменьшению акне [7]. Не менее важным при назначении Диане-35 у пациенток с бесплодием и СПКЯ является действие препарата на морфологическое состояние яичников. Так, в динамике применения препарата при ультразвуковом сканировании показано значительное уменьшение количества и размеров фолликулов, соответственно, уменьшение размеров яичников и степени выраженности гиперпластических процессов в строме. Процент стимуляции овуляции в первые 3-4 мес отмены препарата, по нашим данным, составляет 25%, а частота наступления беременности - 15%. Этот этап терапии не является основным в лечении бесплодия, а лишь готовит пациентку к последующему применению прямых и непрямых стимуляторов овуляции, повышая их эффективность на 18-25%. Побочные реакции при применении Диане-35 проявляются в виде головной боли, мигрени, тошноты, рвоты, болезненности молочных желез, депрессии и не превышают 23%, полностью исчезая в первые месяцы лечения. Отказ от применения препарата составляет 9%. Единое мнение о применении глюкокортикоидов у женщин с хронической ановуляцией и гиперандрогени-ей до настоящего времени отсутствует. Так, все клиницисты признают необходимость заместительной глюкокор-тикоидной терапии у пациенток с различными формами ВДКН, в то же время обоснованность использования дек-саметазона у других групп пациенток с гиперандрогени-ей вызывает существенные разногласия [8, 9]. Данные, полученный О.И.Глазковой (1999), свидетельствуют о том, что значительная группа пациенток с хронической ановуляцией и гиперандрогенией имеет сочетание стертых дефектов стероидогенеза и повышение функции коры надпочечников [10]. Вероятно, этим объясняется эффективность глюкокортикоидной терапии у части женщин с яичниковой гиперандрогенией, в том числе при СПКЯ. Эффективность глюкокортикоидной терапии у пациенток с хронической гиперандрогенной ановуляцией в плане наступления беременности составила 18%. Показана зависимость эффективности этого вида терапии бесплодия при дисфункции коры надпочечников от возраста женщины, длительности нарушений менструальной функции, наличия или отсутствия ПКЯ [10]. Полученные результаты позволяют считать, что применение низких доз глюкокортикоидов показано женщинам со стертой формой ВДКН, гетерозиготным носительством гена недостаточности 21-гидроксилазы, надпочечниковой гиперандрогенией и бесплодием при высоком уровне ДГАС, ДЭА или 17-КС. Длительность терапии дексаметазоном определяется периодом нормализации уровня андрогенов, после чего возможно проведение стимуляции овуляции кломидом на фоне продолжающегося приема глюкокортикоидов. Следующий, основной этап терапии бесплодия в сочетании с гипеандрогенией и хронической ановуляцией включает в себя стимуляцию овуляции кломидом или препаратами ЧМГ/ЧХГ. Пациенткам с отсутствием стимулирующего эффекта после лечения только дексаметазоном начата стимуляция овуляции с использованием кломида на фоне продолжающегося приема препарата. Пациенткам с отсутствием надпочечниковой гиперандрогении проводили стимуляцию только кломидом. Стимуляция овуляции отмечена у 56% пациенток с изолированным применением кломида и у 57% при сочетан-ной терапии с дексаметазоном. Беременность наступила у 29 и 31% женщин соответственно. Наши результаты совпадают с данными многочисленных исследователей о том, что частота наступления беременности у пациенток с ановуляцией и гиперандрогенией при лечении кломи-дом в 1,5-2 раза ниже частоты стимуляции овуляции [11]. У 43% пациенток диагностировано состояние резне-тентности к кломиду - применение препарата в дозе 250-750 мг на курс лечения не дало стимулирующего эффекта. Больным, резистентным к терапии кломидом, а также пациенткам, у которых беременность не наступила, несмотря на овуляторый характер циклов, было рекомендовано проведение эндоскопического исследования для исключения сопутствующей патологии органов малого таза и проведение хирургической стимуляции овуляции - клиновидной резекции яичников (КРЯ). Сопутствующая патология органов малого таза диагностирована у 48% больных с отсутствием беременности: спаечный процесс в малом тазу с/без нарушения проходимости маточных труб, наружный генитальный эндоме-триоз I степени, фолликулярные и дермоидные кисты яичников, миома матки, порок развития матки (неполная внутриматочная перегородка). Всем пациенткам с ПКЯ производили КРЯ. Неоднократно в своих публикациях мы останавливались на роли эндоскопических методов в клинике женского бесплодия, указывая на то, что несоблюдение международных и отечественных стандартов приводит к значительному снижению эффективности лечения бесплодия в браке [12]. Результаты обследования, казалось бы чисто эндокринной группы, подтвердили, что практически у каждой второй больной отсутствие эффекта от гормональной стимуляции овуляции объясняется наличием органической патологии гениталий. В течение 3 мес после операции КРЯ менструальный цикл нормализовался у 2/3 больных вне зависимости от сопутствующей патологии органов малого таза. В целом после лапароскопии и КРЯ беременность наступила у 24% больных. Частота наступления беременности у пациенток с сопутствующей патологией была в 1,7 раза ниже, чем у пациенток без органического поражения органов малого таза. Результаты многочисленных исследований показали, что оперативная лапароскопия может конкурировать с гормональными методами стимуляции [7]. Преимуществами метода является восстановление овуляции в течение нескольких циклов после операции, что возникает после однократной процедуры, развитие и овуляция только одного фолликула в цикле и, следовательно, отсутствие осложнений, присущих гормональной стимуляции, отсутствие риска возникновения спаек и атрофии яичниковой ткани вследствие чрезмерного удаления ткани яичников [2]. В связи с полученными данными представляется, что у пациенток с бесплодием, хронической ановуляцией и гиперандрогенией лечебно-диагностическая лапароскопия должна стать одним из первых этапов обследования и лечения. В случае отказа пациентки от операции в начале терапии эндоскопическое обследование следует рекомендовать при неэффективной гормональной терапии. Стимуляция овуляции кломидом после операции привела к наступлению беременности дополнительно в 32% случаев. У 28% пациенток проведение хирургического вмешательства на яичниках позволило преодолеть состояние кломифен-резистентности. Для пациенток с отсутствием эффекта от применения кломида, следующим этапом лечения является использование препаратов ЧМГ как одного из наиболее сложных методов, сопровождающихся высокой частотой побочных реакций и осложнений. Синдром гиперстимуляции яичников (СГЯ) и наступление многоплодной беременности являются серьезной проблемой при стимуляции овуляции ЧМГ, вызывая осложнения как со стороны матери, так и со стороны плода [11]. В настоящее время стимуляция овуляции препаратами ЧМГ проводится по традиционной схеме и в режиме низких доз. Сравнительная клинико-гормональная оценка обоих методов позволила сделать вывод о преимуществах режима низких доз конкретно для пациенток с гиперандрогенией и ановуляцией. Изучение особенностей циклов стимуляции овуляции препаратами ЧМГ в этом режиме указало на приближенность его параметров к нормальному спонтанному менструальному циклу, когда имеет место формирование одного доминантного фолликула (81% моноовуляторных циклов). Причем показана возможность спонтанной овуляции и наступления беременности без назначения ЧХГ. Стимуляция овуляции в режиме низких доз приводит к наступлению беременности у 58% пациенток с хронической ановуляцией и гиперандрогенией, что достоверно не отличается от соответствующего показателя при традиционной схеме (43%). Однако эффективность лечения в расчете на цикл стимуляции при режиме низких доз оказалась почти вдвое ниже. Все беременности, наступившие в результате стимуляции овуляции ЧМГ в режиме низких доз, были одноплодными. Максимальная приближенность параметров цикла стимуляции овуляции препаратами ЧМГ в режиме низких доз к естественному циклу может объяснить снижение частоты СГЯ и самопроизвольных выкидышей в этой группе пациенток, что повышает реальную эффективность лечения бесплодия.
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.