Характерные признаки болезни, связанной с нарушением окислительного декарбоксилирования аминокислот с разветвленным радикалом, проявляются в конце первой недели после рождения: запах мочи больного напоминает запах кленового сиропа или жженого сахара, затруднения при кормлении, рвота. В плазме и в моче сильно повышается содержание аминокислот с разветвленной цепью — лейцина, изолейцина и валина, а также соответствующих им а-кетокислот У выживших детей отмечены выраженные нарушения функций мозга. Без лечения летальный исход наступает к концу первого года жизни. Механизм токсического действия накапливающихся соединений пока неизвестен.Для лечения используют диету с заменой белков на смесь очищенных аминокислот, не содержащую лейцина, изолейцина и валина. После достижения нормального уровня этих аминокислот, можно использовать белковые продукты (молоко или другие продукты), но в количествах, не превышающих потребность в аминокислотах с разветвленной цепью. Нет сведений о том, можно ли впоследствии ослабить ограничения в диете и когда именно. Если лечение было начато в первую неделю жизни ребенка, удается значительно смягчить тяжелые проявления болезни.
При относительно меньших изменениях активности декарбоксилазы болезнь может проявляться в форме скачкообразной кетонурии (разветвленных кетокислот). Хотя активность декарбоксилазы в лейкоцитах и фибробластах таких больных значительно ниже нормы, но всё же существенно выше, чем в классических случаях болезни «кленового сиропа».Типичные симптомы болезни «кленового сиропа» проявляются позднее и наблюдаются лишь эпизодически. Прогноз при назначении соответствующей диеты более благоприятный.
Известны заболевания, связанные с недостаточностью ферментов, катализирующих специфические для данной аминокислоты реакции. Так при недостаточности изовалерил-СоА-дегндрогеназы развивается изовалериановая ацидемия. У больногоэто проявляется в форме появлениязапаха сыра у выдыхаемого воздуха и жидкостей организма, рвота, ацидоз и даже кома; которая возникает после избыточного потребления белка или после инфекционного заболевания. Возможна умеренная задержка умственного развития.
Описана также гнпервалинемия, которая характеризуется повышенным содержанием в плазме валина. При этом состоянии нарушено переаминирования валина с образованием а-кетоизовалерата хотя переаминирование лейцина и изолейцина не нарушается.
Самое большое из всех семейств аминокислот - это семейство ацетил-КоА. Это и не удивительно, поскольку ацетил-КоА один из важнейших промежуточных метаболитов клетки. Семейство пирувата (аланин, цистеин, цистин, глицин, серии и треонин), можно считать принадлежащим и к семейству ацетил-КоА (см обмен углеводов). 5 аминокислот (тирозин, фенилаланин лейцин, лизин и триптофан) образуют ацетоацетил-СоА, который легко превращается в ацетилКоА . Тирозин и фенилаланин одновременно можно рассматривать и как членов семейства фумарата. Изолейцин, лейцин и триптофан являются прямыми источниками ацетил-КоА
Основной и,
по-видимому, единственной функцией фенилаланина, не считая участия в синтезе
белков и пептидов, является использование его в качестве источника тирозина. 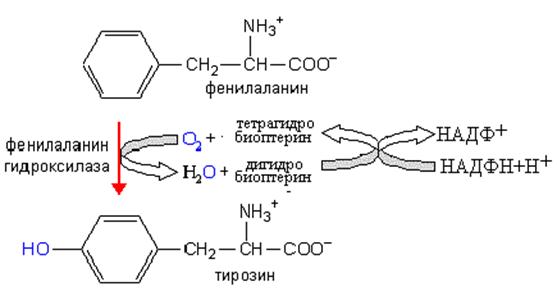
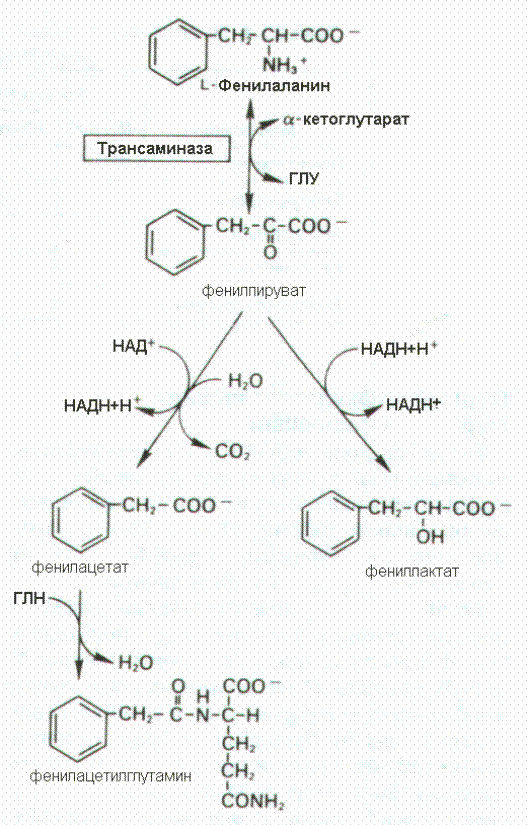
Эта реакция катализируется фенилаланингидроксилазой- ферментом, который обладает двумя каталитическими активностями: дигидробиоптеринредуктазной (восстановление дигидробиоптерина с участием НАДФН+Н+ в тетрагидробиоптерил) и гидроксилазной (восстановление О2 в воду и фенилаланина в тирозин). Фенилаланин может подвергаться переаминированию с a-кетоглутаровой кислотой с образованием фенилпирувата. катализируется фенилаланингидроксилазой- ферментом, который обладает двумя каталитическими активностями: дигидробиоптеринредуктазной (восстановление дигидробиоптерина с участием НАДФН+Н+ в тетрагидробиоптерил) и гидроксилазной (восстановление О2 в воду и фенилаланина в тирозин). Фенилаланин может подвергаться переаминированию с a-кетоглутаровой кислотой с образованием фенилпирувата. Фенилпировинофениллактата или подвергается окислительному
декарбоксилированию, продукт которого связываясь с глутамином в форме фенилацетилглутамина выделяется. Эти реакции протекает в печени у здоровых людей, однако количество катаболизируемого таким образом фенилаланина незначительно. Эти пути приобретают значимость при нарушении функции фенилаланингидроксилазырадная
декарбоксилированию, продукт которого связываясь с глутамином в форме фенилацетилглутамина выделяется. Эти реакции протекает в печени у здоровых людей, однако количество катаболизируемого таким образом фенилаланина незначительно. Эти пути приобретают значимость при нарушении функции фенилаланингидроксилазырадная кислота восстанавливается с образованием фениллактата или подвергаетсядекарбоксилированию, продукт которого связываясь с глутамином в форме фенилацетилглутамина выделяется. х людей, однако количество катаболизируемого таким образом фенилаланина незначительно. Эти пути приобретают значимость при нарушении функции фенилаланингидроксилазы
 |
Нарушение функции фенилаланин гидроксилазы – причина фенилкетонурии
Учитывая указанные выше особенности функции фенилаланингидрокислазы, могут быть три основные причины нарушения превращения фенилаланина в тирозин
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.