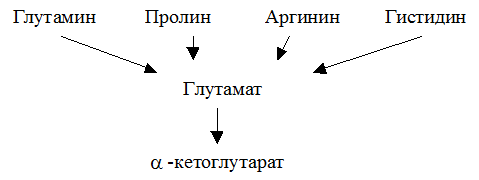
Глутаминовая кислота занимает важное место в промежуточном обмене нескольких аминокислот. К ним относятся глутамин, пролин, аргинин и гистидин.
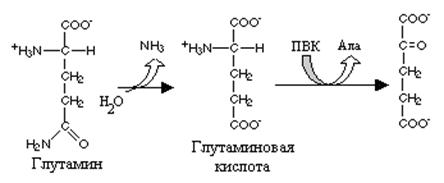
Реакция превращения глутамина в глутаминовую кислоту напоминает превращение аспарагина в аспарагиновую и катализируется глутаминазой. Учитывая, что глутамин - главная транспортная форма аммиака глутаминаза играет важную роль в органах, активно использующих аммиак и прежде всего в печени и почках.
 |
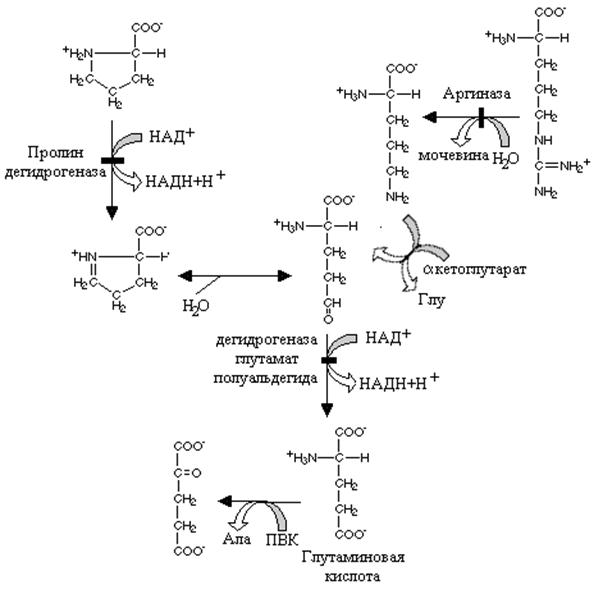
Дегидрогеназа пролина окисляет молекулу пролина с образованием продукта (дегидропролин), который спонтанно неферментативным путем гидролизуется с образованием глутаминового полуальдегида. Путь к этому соединению у аргинина начинается с реакции, катализируемой аргиназой и орнитин –продукт этой реакции после переаминирования с a –кетоглутаратом также превращается в глутаминовый полуальдегид. Специфическая дегидрогеназа глутаминового полуальдегида окисляет его с образованием глутаминовой кислоты.
 |
Глутаминовая кислота, которая образуется из указанных выше аминокислот превращается в a кетоглутаровую реакцией переаминирования
Глутаминовая кислота, аспарагиновая кислота и аланин образуются одноступенчатой реакцией из центральных метаболитов. Они просты по структуре, и их синтез также не сложен.
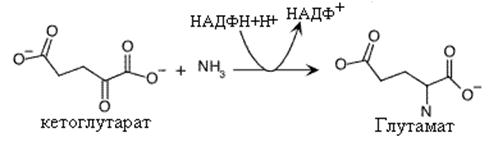
Синтез глутаминовой кислоты.
Глутаминовая кислота синтезируется присоединением аммиака к a-кетоглутарату. Эта реакция способствует усвоению аммиака клетками и использованию его в синтезе других аминокислот. Кроме того, сама глутаминовая кислота используется как субстрат в синтезе некоторых аминокислот. Реакция катализируется глутаматдегидрогеназой. Донором водородов в этой реакции является НАДФН+Н+. Реакция восстановительного аминирования является обратной окислительному дезаминированию, в которой глютаматдегидрогеназа использует НАД+ в качестве акцептора водородов. Эта особенное отношение к коферментам придает глютаматдегидрогеназе своеобразные трансдегидрогеназные свойства, связывающие между собой НАД+ и НАДФ+ зависимые процессы.
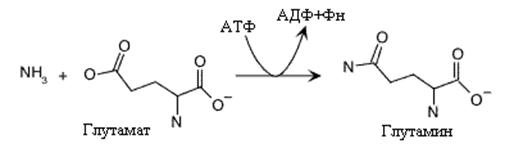 |
Образование глутамина это еще одна реакция обеспечивающая ассимиляцию аммиака клеткой. Реакция экзэргоническая и использует АТФ для образования амидной связи. Глутаминсинтетаза, катализирующая эту реакцию представляет аллостерический фермент, с большим числом регуляторов. Аллостерическими ингибиторами глутаминсинтетазы у млекопитающих являются глицин, аланин, серин, карбомоилфосфат, активатором- a-кетоглутарат. У микроорганизмов регуляция активности этого фермента еще более сложная. Глутамин –это главная транспортная форма аммиака в крови и донор аминогруппы в синтезе многих азотсодержащих соединений.
Остальные простые реакции включают перенос аминогруппы (переаминирование) от глутамата или глютамина на метаболит центральных путей метаболизма для получения требуемой аминокислоты. Аспарагиновая кислота синтезируется переносом аминогруппы от глутамата на оксалоацетат.
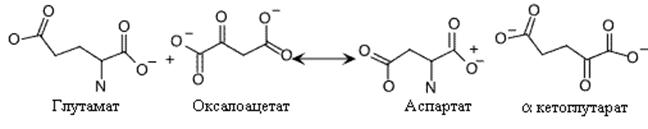
. Синтез аспарагиновой кислоты.
Эта реакция – простой пример возможного использования аммиака клетками для синтеза аминокислот при посредничестве реакций, ассимилирующих аммиак (глутаматдегирогеназная реакция).
Образование аспарагина у млекопитающих отличается от образования глутамина. Аспарагинсинтетаза катализирует энергозависимый перенос аминогруппы глутамина на аспарагиновую кислоту, Это сопровождается более глубоким гидролизом АТФ.У микроорганизмов и растений механизм синтеза аспарагина аналогичен глутаминсинтетазной реакции и протекает с использованием аммиака
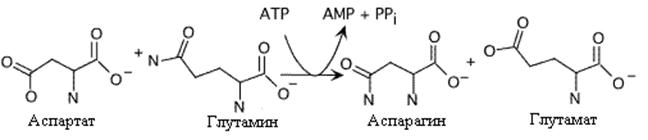
или
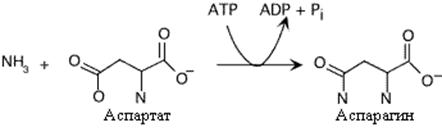
Образование аспарагина. Следует отметить использование AMФ вместо AДФ в этой реакции Это высвобождает больше энергии, необходимой для синтеза.
В основе механизма синтеза аланина также лежит переаминирование. В этой реакции участвуют глутаминовая (донор аминогруппы) и пировиноградная (акцептор аминогруппы) кислоты. У микроорганизмов в этой реакции возможно использование валина вместо глутамата.
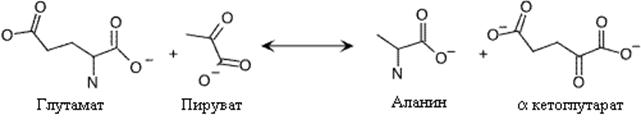
. Синтез аланина
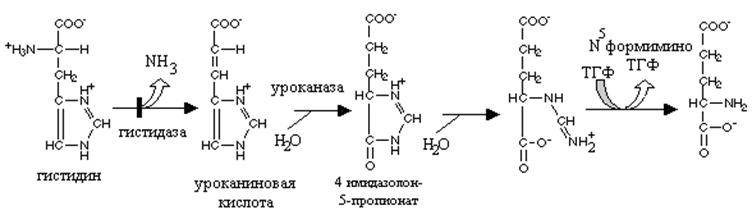
Нарушения путей превращения аминокислот в глутаминовую кислоту проявляются по-разному. При врожденной недостаточности дегидрогеназы пролина развивается гиперпролинемия I типа, а при недостаточности дегидрогеназы глутаминового полуальдегида - гиперпролинемия II типа. Оба типа наследуются, вероятно, по аутосомно-рецессивному типу и часто сопровождаются умственной отсталостью, однако эти нарушения не считаются опасными для жизни. Степень гиперпролинемии в случае типа II выше, чем при гиперпролинемии типа I. У больных с гиперпролнемией II типа в моче обнаруживается А'-пирролин-З-гидрокси-5-карбоксилат продукт распада гидроксипролина.
Гипераргининемия развивается при недостаточности аргиназы в печени (см раздел по механизмам образования мочевины).
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.