Схема электронных уровней атома водорода:
 Во время перехода
момент импульса всегда изменяется на
Во время перехода
момент импульса всегда изменяется на ![]() (правило отбора). Момент импульса
фотона равен
(правило отбора). Момент импульса
фотона равен ![]() .
.
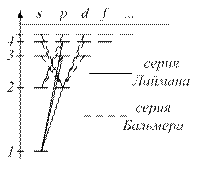
Спектры атомов щелочных металлов
Частоты серий
этих атомов: 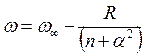 (здесь R
– постоянная Ридберга). Для разных атомов и
(здесь R
– постоянная Ридберга). Для разных атомов и ![]() , и a – разное.
, и a – разное.
Резкая серия: 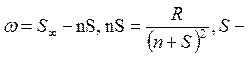 число,
число, ![]() .
.
Главная серия: 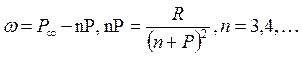 .
.
Диффузная
серия: ![]() .
.
Основная линия:
![]() .
.
Эмпирически
было установлено, что ![]() .
.
Энергия состояния (энергия уровня) зависит не только от главного квантового числа, но и от орбитального (азимутального) квантового числа – это главное отличие атомов щелочных металлов от атома водорода.
Магнитное число определяет проекцию момента импульса на выбранное направление.
Правила сложения моментов импульса
Пусть есть две
частицы с моментами импульса ![]() и
и ![]() . Найдём суммарный момент импульса системы
. Найдём суммарный момент импульса системы ![]() . Известно, что
. Известно, что ![]() .
Аналогично и для
.
Аналогично и для ![]() и
и ![]() . Т.к.
. Т.к. ![]() , то проекции их на ось z
, то проекции их на ось z ![]() . При
этом
. При
этом ![]() .
.
Нормальный эффект Зеемана
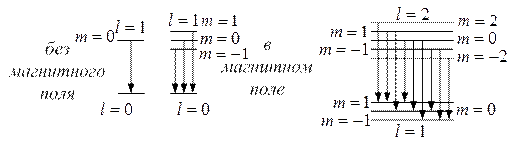
Магнитный момент электрона на орбите 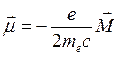 , где
, где ![]() – механический момент,
– механический момент, ![]() , l –
азимутальное квантовое число. Тогда
, l –
азимутальное квантовое число. Тогда 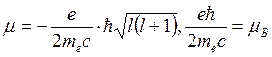 – магнетон Бора.
Потенциальная энергия электрона в магнитном поле
– магнетон Бора.
Потенциальная энергия электрона в магнитном поле ![]() , где
, где ![]() – напряжённость внешнего магнитного поля.
– напряжённость внешнего магнитного поля. 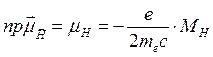 . Пусть
. Пусть ![]() . Тогда
. Тогда ![]() и
и 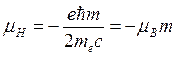 , где m – магнитное квантовое число. Таким образом,
, где m – магнитное квантовое число. Таким образом, ![]() , следовательно, при помещении атома в
магнитное поле его уровни возбуждения расщепляются на
, следовательно, при помещении атома в
магнитное поле его уровни возбуждения расщепляются на ![]() значение
(т.к.
значение
(т.к. ![]() через 1), равноотстоящие друг от друга.
Магнитное поле снимает вырождение по квантовому числу m.
через 1), равноотстоящие друг от друга.
Магнитное поле снимает вырождение по квантовому числу m.
Правило отбора:
![]() . При этом энергии переходов с одинаковым
изменением m равны и при
. При этом энергии переходов с одинаковым
изменением m равны и при ![]() равны
энергии перехода без магнитного поля.
равны
энергии перехода без магнитного поля.
Мультиплетность спектров и спин электрона
У щёлочных
металлов расщепление линий перехода ![]() различно, а
различно, а ![]() – одинаково.
– одинаково.
Мультиплетность – расщепление линий на несколько компонент.
Собственный момент импульса электрона называется спином.
Квантовое
число, соответствующее спину – s. Для электрона ![]() . Тогда спин электрона
. Тогда спин электрона 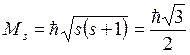 . Проекция спина на ось z
. Проекция спина на ось z ![]() , где
, где 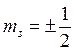 для электрона. Отношение магнитного
момента к механическому для электрона:
для электрона. Отношение магнитного
момента к механическому для электрона: 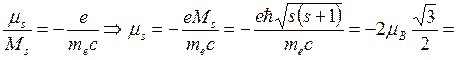
![]() . Знак «–» означает, что
. Знак «–» означает, что ![]() .
. 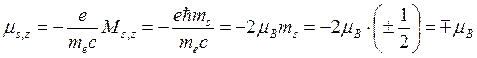 .
.
Если в атоме
один валентный электрон (атом щелочного металла), то полный магнитный момент ![]() , где
, где ![]() через
1. Для одного электрона
через
1. Для одного электрона 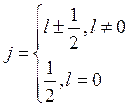 . Из-за того, что для
уровней, у которых
. Из-за того, что для
уровней, у которых ![]() полный магнитный момент
полный магнитный момент ![]() может принимать два значения, то и
магнитный момент будет иметь два значения и состояния с различными значениями j будут обладать различной энергией.
может принимать два значения, то и
магнитный момент будет иметь два значения и состояния с различными значениями j будут обладать различной энергией.
Взаимодействие магнитных моментов электрона и атома называется спин-орбитальным взаимодействием. Им объясняется расщепление линий на две компоненты.
Правило отбора:
![]() .
.
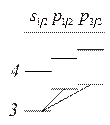 Терм – местонахождение атома среди его энергетических
уровней.
Терм – местонахождение атома среди его энергетических
уровней.
Обозначение: ![]() .
.
Результирующий момент многоэлектронного атома
Путём сложения
всех моментов электрона, как собственных, так и орбитальных, возникает полный
механический момент атома. Он получается двумя способами: если в атоме
присутствует связь Ресселя-Сандерса, то взаимодействие собственных магнитных
моментов и взаимодействие орбитальных моментов электронов сильнее, чем
взаимодействие собственных и орбитальных моментов электронов. Тогда 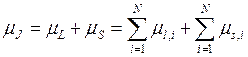 , где N –
число электронов,
, где N –
число электронов, ![]() и
и ![]() – соответственно
орбитальный и собственный моменты i-го
электрона. Иначе в атоме присутствует j-j-связь. Тогда
– соответственно
орбитальный и собственный моменты i-го
электрона. Иначе в атоме присутствует j-j-связь. Тогда 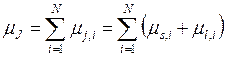 . Эта связь встречается
реже и свойственна тяжёлым атомам.
. Эта связь встречается
реже и свойственна тяжёлым атомам.
Можно
представить ![]() так:
так: ![]() , где g – фактор Ланде, зависящей от L
и S.
, где g – фактор Ланде, зависящей от L
и S.
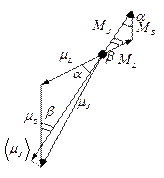 Среднее по времени
значение полного магнитного момента
Среднее по времени
значение полного магнитного момента ![]() . При этом
. При этом ![]()
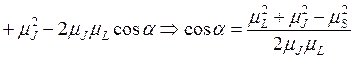 . Аналогично
. Аналогично 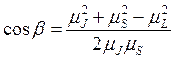 . Тогда
. Тогда 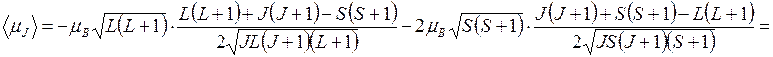
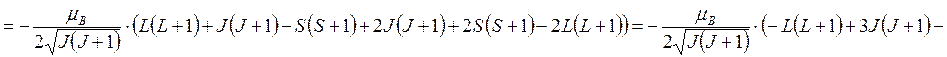
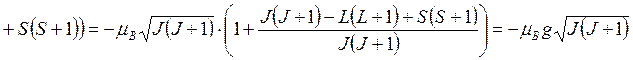 .
.
Распределение электронов в атоме по энергетическим уровням
Принцип Паули: В одной и той же квантовой системе не может быть двух частиц с полуцелым спином, обладающих одним и тем же набором квантовых чисел.
Состояние
электронов в атоме характеризуется числами: ![]()
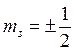 .
.
Основным состоянием атома является такое, которое обладает минимальной энергией.
Вырождение по
числу ![]() для электрона равно
для электрона равно ![]() . При
. При  – 2
электрона,
– 2
электрона, 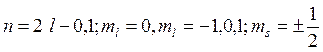 .
.
Совокупность электронов, характеризующихся одинаковым главным квантовым числом, называется слоем.
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.