Исследования при разных температурах показывают различную температурную зависимость подвижностей катионов и анионов. С понижением температуры подвижность ионов свинца падает быстрее, чем ионов йода. При 2600С электропроводность на 40% обязана ионам Рb++ и на 60% - ионам J-, а при 1550С на долю ионов Рb++ приходится только 0,4% электропроводности. При низких температурах в указанных солях подвижность в основном обусловлена анионами, а при высоких температурах - катионами. При низких температурах электропроводность очень чувствительна к обработке образца и примесям.
Благодаря положительному температурному коэффициенту электропроводность с повышением температуры растет, но для большинства ионных кристаллов даже при высоких температурах она оказывается очень малой. Однако в некоторых веществах электропроводность становится исключительно большой. Такое поведение электропроводности находит объяснение в особенностях структуры этих веществ. Примерам может служить йодид серебра, существующий в трех модификациях. Структуры первых двух модификаций y-АgJ (тип сфалерита), ß-АgJ (тип вюрцита) соответствуют хорошо известным низко- и высокотемпературным модификациям сульфида цинка ZnS. Кубическая структура высокотемпературной модификации α-AgJ, устойчивой выше 1460С, имеет период а = 5,03 А и содержит две частицы в ячейке. Ионы йода образуют объемно-центрированную структуру со статистическим расположением ионов серебра по дыркам этой структуры. Плотность α-АgJ на 15% больше, чем ß-АgJ, а электропроводность вблизи точки перехода в 4000 раз больше электропроводности ß-АgJ. Вблизи точки плавления (5520С) электропроводность твердого α-АgJ несколько больше, чем расплавленного йодида серебра, тогда как для других солей при плавлении наблюдается возрастание электропроводности (для NaCl. например, в 3000 раз). Высокая электропроводность α-АgJ объясняется особенностями структуры этой модификации. В структуре α-АgJ имеется значительное число дырок, которые могут быть заняты ионами серебра, но остаются вакантными, так как число дырок превышает число ионов серебра. Энергия активации диффузии ионов серебра по этим дыркам очень мала Q = 600 кал/ г-атом.
Предположение о возможности использования вакантных дырок подтверждается исследованием структуры и электрических свойств двух полиморфных модификаций
Ag2HgJ4, близких по структуре ß-АgJ. Введение двухвалентных ионов ртути в йодид серебра приводит к образованию дырок по схеме Ag4J4 → Аg2НgдJ4, где символом д обозначена дырка в структуре. На рис. 258 показана связь структур рассматриваемых веществ.
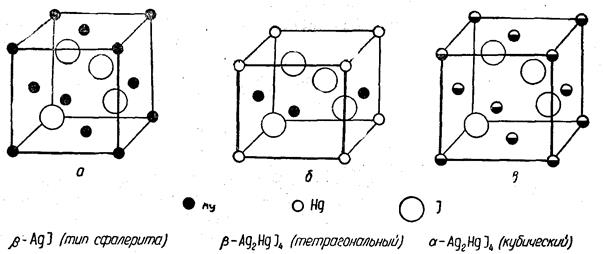
Рис. 258. Структуры полиморфных модификаций Ag2HgJ4
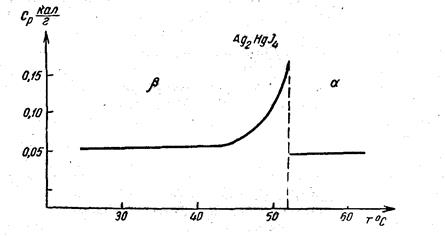
Рис. 259 Изменение теплоемкости при полиморфном превращении β→Ag2HgJ4
Во всех случаях ионы йода образуют структуру гранецентрированного типа. Ионы серебра ß-АgJ занимают места другой гранецентрированной решетки (рис. 258, а). В ß-Аg2НgJ4 четверть узлов этой решетки остается вакантной (на рис. 258, б - центры верхней и нижней граней), и ячейка приобретает тетрагональную симметрию, хотя по форме остается кубической (с/а = 1,00). Структура α-Аg2НgJ4 является кубической со статистическим размещением трех катионов по четырем узлам решетки (рис. 258, в). Переход из ß- в α - модификацию совершается постепенно, так как с повышением температуры увеличивается число катионов в вакантных узлах. Этот переход является фазовым переходом второго рода от порядка к беспорядку и сопровождается скачком теплоемкости (рис. 259). Скорость превращения заметно возрастает начиная с 400С и завершается при температуре Кюри Tk = 500,7С, при этом соединение меняет цвет и из желтого становится оранжевым.
Электропроводность α-Аg2НgJ4 исключительно велика и в области температур около 500С в тысячи раз превосходит электропроводность любого другого твердого электролита и описывается формулой Q =4*102e-8600/T.Хотя ионные радиусы Ag+ и Hg++ приблизительно одинаковы, но, как показывают опыты с переносом, только 6% заряда переносится ионами ртути. Уменьшение подвижности ионов ртути связано с их большим зарядом. Изложенное позволяет рассматривать α-Аg2НgJ4 как кристалл, в котором произошло плавление одной части структуры - катионной решетки при сохранении упорядоченного кристаллического состояния другой составной частью-анионной решеткой. В некотором отношении указанные кристаллические электролиты приближаются к металлам, но только роль свободных электронов здесь осуществляют катионы.
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.