Лекция 16. ФАЗОВЫЕ ПРЕВРАЩЕНИЯ ВЕЩЕСТВА.
ФАЗОВЫЕ ПЕРЕХОДЫ I РОДА.

Фазой называется термодинамически равновесное состояние вещества, отличающееся по физическим свойствам от других возможных равновесных состояний того же вещества.

Фазовым переходом называется процесс перехода из одного термодинамически равновесного состояния в другое.

Фазовым переходом I рода называется процесс, происходящий при постоянной температуре, сопровождающийся поглощением или выделением теплоты, изменением энтропии и объема вещества.

Теплотой фазового перехода L (скрытой теплотой) называется количество поглощаемой или выделяемой теплоты при фазовом переходе I рода.
![]() Пусть температуры рассматриваемых процессов
Т1= T, и Т2= T-dT.
Пусть температуры рассматриваемых процессов
Т1= T, и Т2= T-dT.
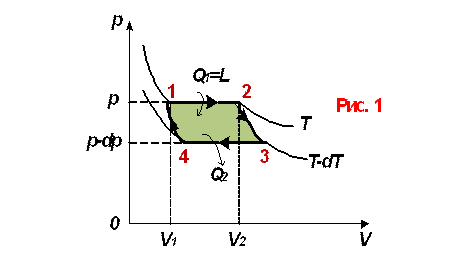
Рассмотрим циклический процесс (рис. 1) 1234 или цикл Карно.
Участку 1-2 р1=р,
![]() а участку 3-4 р2=р-dp.
а участку 3-4 р2=р-dp.

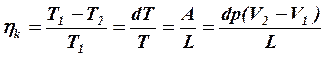 ,
,
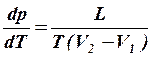 (1)
- уравнение Клапейрона-Клаузиуса.
(1)
- уравнение Клапейрона-Клаузиуса.
1)
![]() Переход: Газ жидкость (рис. 2).
Переход: Газ жидкость (рис. 2).
 С течением времени давление
пара = const.
С течением времени давление
пара = const.
![]()
![]() Если T↑ p↑, жидкость
газ = испарение
Если T↑ p↑, жидкость
газ = испарение

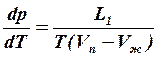 (2)
(2)
L1>0, Vп-Vж>0 и 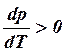 .
.
Следовательно, при увеличении давления увеличивается температура, при которой преобладает процесс парообразования.

Диаграммой состояния называется кривая зависимости между давлением и температурой фазового перехода. Любая точка этой кривой соответствует равновесию двух фаз.

![]() Переход: газ
жидкость = конденсация
Переход: газ
жидкость = конденсация ![]() , L1< 0 (рис. 3).
, L1< 0 (рис. 3).

АК – фазовая диаграмма перехода
![]() газ
жидкость
газ
жидкость
Точки АК – равновесие двух фаз
Парообразованием и конденсацией называются фазовые переходы I рода из жидкого состояния в газообразное и наоборот.
2)
![]() Газ
кристалл
Газ
кристалл
При низких давлениях газ переходит в твердое состояние – кристаллизуется.

Сублимацией (возгонкой) называются фазовые переходы I рода из твердого состояния в газообразное, и наоборот.
![]() газообразное
кристаллическое L2<0.
газообразное
кристаллическое L2<0.
![]() кристаллическое
газообразное L2>0.
кристаллическое
газообразное L2>0.

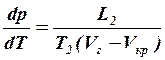 (3)
T2 – температура сублимации.
(3)
T2 – температура сублимации.
Точки ОА – равновесие двух фаз: газ - твердое тело (рис. 4)

3)
![]() жидкость
кристалл
жидкость
кристалл
![]() При
низкой температуре и давлении: жидкость кристалл = кристаллизация L3<0, плавление
L3>0.
При
низкой температуре и давлении: жидкость кристалл = кристаллизация L3<0, плавление
L3>0.

Плавлением и кристаллизацией называются фазовые переходы I рода из твердого состояния в жидкое, и наоборот.

Уравнение перехода 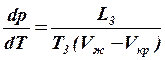 (4), где T3 – температура плавления.
(4), где T3 – температура плавления.
При плавлении:
 а)
для большинства веществ (металлы):
а)
для большинства веществ (металлы): 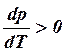 и Vж>Vкр
и Vж>Vкр
 б) для
небольшого количества веществ (вода, чугун и т.д.)
б) для
небольшого количества веществ (вода, чугун и т.д.) 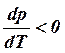 и Vж<Vкр.
и Vж<Vкр.
|
 Кривые плавления не имеют конца (рис. 5).
Кривые плавления не имеют конца (рис. 5).
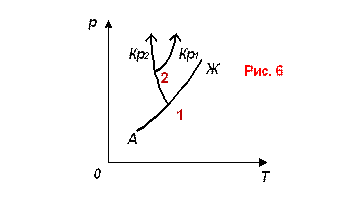
![]() кристалл
кристалл (рис. 6)
кристалл
кристалл (рис. 6)

Полиморфными превращениями называются фазовые переходы в твердых телах из одной кристаллической модификации в другую.
Например, углерод может существовать в виде графита и алмаза, имеется много модификаций льда, сера существует в двух модификациях.
 Уравнение перехода
Уравнение перехода 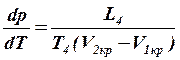 (5)
(5)

Тройной точкой (рис. 7) называется точка А пересечения фазовых диаграмм, т.е. при определенных давлении и температуре возможно равновесное существование трех фаз вещества.

А – тройная точка
|
ФАЗОВЫЕ ПЕРЕХОДЫ II РОДА.

Фазовым переходом II рода называется процесс, сопровождающийся скачкообразным изменением теплоемкости и не сопровождающийся поглощением или выделением теплоты ( L=0), без изменения энтропии и объема вещества.
Особенности:
1) Фазовые переходы II рода происходят одновременно по всему веществу.
2) Пространственно не разделены фазы.
3) Нет равновесия фаз.
Фазовые переходы II рода (примеры):
1) переход ферромагнетика в парамагнитное состояние, не сопровождается изменением кристаллической структуры. Этот переход обусловлен переориентировкой магнитных моментов электронов.
2) переходы металлов в сверхпроводящее
состояние и переход гелия I в гелий II. В этом состоянии гелий остается жидким
практически до ![]() .
.

Температурой Кюри называется температура, при которой происходит фазовый переход II рода.
ПОВЕРХНОСТНОЕ НАТЯЖЕНИЕ. СВОБОДНАЯ ЭНЕРГИЯ.
![]()
![]()
![]()
![]()
![]()
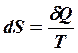
При изотермическом обратимом процессе
![]()
![]() (1)
(1)

Свободной энергией
называется функция состояния ![]() (2), изменение которой при изотермическом процессе
равно работе системы
(2), изменение которой при изотермическом процессе
равно работе системы ![]() или
или ![]() .
.

![]()
![]()
![]() Свободной поверхностной энергией
Свободной поверхностной энергией ![]() называется добавочная
потенциальная энергия жидкости, обусловленная разностью энергии
поверхностных молекул и молекул внутри жидкости
называется добавочная
потенциальная энергия жидкости, обусловленная разностью энергии
поверхностных молекул и молекул внутри жидкости
~ N~S ~V

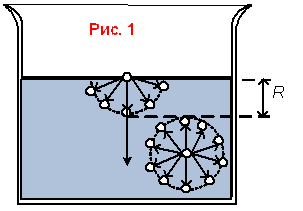
Поверхностным натяжением жидкости (рис. 1) называется скалярная величина численно равная свободной поверхностной энергии приходящейся на единицу поверхности

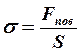 (2).
(2).
Изотермическое увеличение поверхности жидкой пленки, созданной в проволочном контуре с подвижной перекладиной (рис. 2).
![]() ,
,![]()
![]()
![]()
![]()
![]() ,
, ![]()


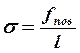 (3)
(3) 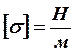
![]()
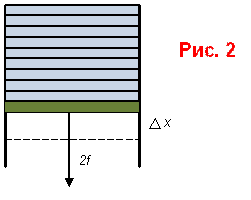 t=0 0С насыщ.
пар
t=0 0С насыщ.
пар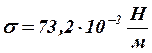
от рода жидкости (в т.ч. примесей),
![]() ~ температуры, давления
~ температуры, давления
состояния газовой среды, с которой граничит жидкость.
При критической температуре ![]() и
и ![]() .
.
Опыт: (проволочный каркас с натянутой мыльной пленкой, петля из нити)(рис. 3).
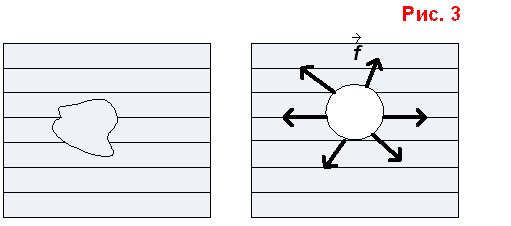
Для воды:
1) вещества, молекулы которых, в основном собираются на поверхности воды (ПАВ) уменьшают поверхностное натяжение и свободную поверхностную энергию.
К таким веществам относятся мыло и другие моющие средства;
2) вещества, которые полностью растворяются в воде, например, сахар и соль увеличивают свободную энергию и поверхностное натяжение.
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.