При отождествлении линий необходимо следить за их взаимным расположением и за относительной интенсивностью (по таблицам).
После того, как в интерполяции эталонного спектра не возникает более сомнений, приступают к анализу спектра пробы.
Путем сравнения двух спектров находят в пробе те линии, которые относятся к определенному элементу (в пробе чистой меди они отсутствуют). Действуют по методу «Проб и исключений». Для этого сравнивают наблюдаемый спектр последовательно с приведенными в атласе и таблицах спектрами всех 15 элементов. Для облегчения этой работы в таблице наиболее характерные линии подчеркнуты и выделены в примечаниях. Удобнее всего начинать с элементов, имеющих наибольшее число линий (Cr, Ca, Sr). Так, например, в таблице спектра хрома отмечены две характерные для хрома линии в области 4485-4001 Å (см. таблицы). Смотрим, имеются ли эти группы в исследуемом спектре. Если их нет, следовательно, определенный элемент не может быть хромом. Опробывают точно таким же образом спектры Ca, Ba, Ag, Zn, Mg и т.д., пока, наконец, не установят природу элемента в исследуемом веществе. После того как искомый элемент установлен, в целях самоконтроля производят измерения длин волн его линий в спектре и сравнивают найденное значение с табличным (если линий много, достаточно ограничиться несколькими, наиболее яркими).
Измерения длин волн производят по методу линейной
интерполяции между близлежащими линиями щели. Этот метод состоит в следующем.
Пусть линия элемента (λх) расположена между линиями меди с длинами
волн λ1 и λ2, указанными в атласе. С помощью линейки
измеряют на экране спектропроектора расстояние между спектральными линиями λ1
и (λ2-а) (ав мм). Величина 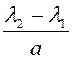 указывает
на цену деления 1 мм в длинах волн. Учитывая это, легко определить длину волны
любой спектральной линии, расположенной между λ1 и λ2.
Для этого необходимо измерить расстояние между неизвестной линией (λх)
и известной (λ1 или λ2). Это будут расстояния b1 и b2. При λ1<λ2
и, если неизвестная линия лежит ближе к λ1, то длина волны
рассчитывается по формуле (1)
указывает
на цену деления 1 мм в длинах волн. Учитывая это, легко определить длину волны
любой спектральной линии, расположенной между λ1 и λ2.
Для этого необходимо измерить расстояние между неизвестной линией (λх)
и известной (λ1 или λ2). Это будут расстояния b1 и b2. При λ1<λ2
и, если неизвестная линия лежит ближе к λ1, то длина волны
рассчитывается по формуле (1)
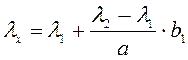 (1)
(1)
Если неизвестная линия расположена ближе к λ2, то расчет λх производится по другой формуле (2):
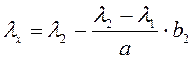 (2)
(2)
Результаты измерений и расчетов заносятся в таблицу 1.
Таблица 1
|
№ спектр. линии |
табл. λх |
λ1 |
λ2 |
а |
b1 |
b2 |
λх измер. |
Найденный элемент |
Контрольные вопросы
1. Как распределяются электроны в атомах? Какие электроны атомов ответственны за получение спектров?
2. Почему одни и те же элементы могут давать в одних случаях сплошной спектр, в других – линейчатый?
3. Что называют спектром? Как он получается? Может ли спектр выглядеть не в виде полосок, в виде набора цветных кружков, точек?
4. Как устроен спектрограф?
5. Как объяснить характеристичность линейчатых спектров?
6. Какие вам известны спектральные закономерности для атома водорода. Почему практически наблюдается лишь небольшое количество серий? Сколько серий водорода наблюдается с помощью спектрографа со стеклянной оптикой?
7. На чем основан и как осуществляется спектральный анализ, в чем его преимущество перед другими методами исследования вещества?
Список литературы
3. Трофимова Т.И. Курс физики. – М.: Высшая школа, 1985. – 432 с.
4. Малышев В.И. Введение в экспериментальную спектроскопию. – М.: Наука, 1979. – 480с.
Лабораторная работа №4ОС
Проверка закона Бугера-Ламберта и построение спектра поглощения водного раствора CaCl2 при помощи фотоколориметра
Цели работы:
- исследовать зависимости интенсивности прошедшего через раствор СаCl2 света от толщины слоя раствора для световых пучков с различной длиной волны;
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.