Экспериментальное определение скорости реакции необязательно связано с непосредственным определением концентрации реагирующих веществ. За ходом реакции можно следить по объему выделяющего газа, по изменению окраски раствора и т.д.. Выбор метода зависит от своеобразия реакции, от простоты и надежности его осуществления, от необходимой точности определения скорости и т.д.. Для сравнения скорости одной и той же реакции в разных условиях часто используют понятие относительной скорости:
 (10)
(10)
где τ – время протекания реакции.
Опыт 1. Зависимость скорости гомогенной реакции от концентрации реагирующих веществ.
Для исследования используйте реакцию взаимодействия тиосульфата натрия с серной кислотой:
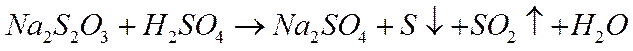
Предварительно проделайте качественный опыт: в пробирку внесите 5–10 капель 1Н раствора Na2S2O3 и 3–5 капель2Н раствора H2SO4 и наблюдайте появление слабой опалесценции и дальнейшее помутнение раствора от образующейся серы.
Приготовьте три раствора тиосульфата натрия различной концентрации. Для этого в три пробирки внесите: в первую (N1) – 4 капли 1Н раствора тиосульфата натрия и 8 капель воды, во вторую (N2) – 8 капель раствора тиосульфата натрия и 4 капли воды, в третью (N3) – 12 капель раствора тиосульфата натрия. Первую и вторую пробирки осторожно встряхните. Если условно обозначить молярную концентрацию Na2S2O3 в пробирке N1 С моль, то соответственно, в пробирке N2 концентрация будет 2С моль, в пробирке N3 – 3С моль.
В пробирку N1 добавьте каплю 2Н раствора Н2SO4 и осторожно встряхните пробирку. В момент добавления кислоты пустите в ход секундомер и измерьте время до появления в растворе слабой опалесценции. Также добавьте по одной капле 2Н раствора Н2SO4 в пробирки N2 и N3 и измерьте время протекания реакции. Полученные данные занесите в таблицу 4.
Таблица 4
|
N пробирки |
Число капель раствора Na2S2O3 |
Число капель Н2О |
Число капель раствора Н2SO4 |
Общий объем раствора (число капель) |
Концентрация Na2S2O3 моль |
Время течения реакции τ, с |
Относительная скорость vотн, с-1 |
|
1 |
4 |
8 |
1 |
13 |
С |
||
|
2 |
8 |
4 |
1 |
13 |
2С |
||
|
3 |
12 |
- |
1 |
13 |
3С |
Начертите график зависимости скорости реакции от концентрации тиосульфата натрия. Сформулируйте вывод о зависимости скорости реакции от концентрации реагирующих веществ. Поясните, каким должен быть график при идеальном выполнении закона действия масс.
Опыт 2. Зависимость скорости гомогенной реакции от температуры.
Приготовьте три пробирки (N1,N2,N3), в каждую из которых внесите по 10 капель 1Н раствора тиосульфата натрия, и пробирку с 2Н раствором серной кислоты и опущенной в него пипеткой.
Пробирку N1, пробирку с раствором серной кислоты и термометр поместите в стакан с водой комнатной температуры и через 3–5 минут запишите показания термометра. Внесите 1 каплю 2Н раствора Н2SO4 в пробирку N1, осторожно встряхните пробирку и секундомером измерьте время до появления слабой опалесценции в пробирке.
Пробирку N2, пробирку с раствором кислоты и термометр поместите в стакан с водой, нагретой до температуры на 10 градусов выше той, при которой находилась пробирка N1. С пробиркой N2 проделайте тот же самый опыт, что и с пробиркой N1. Точно также поступите с пробиркой N3, повысив температуру воды еще на 10 градусов.
Полученные данные напишите в таблицу 5.
Таблица 5
|
N пробирки |
Температура t, °С |
Время течения реакции τ, с |
Относительная скорость реакции v(t)отн, с-1 |
Повышение скорости при увеличении t на 10°С, v(t+10)отн./v(t)отн. |
|
1 |
||||
|
2 |
||||
|
3 |
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.